Ominaisuudet Globaariset proteiinit, rakenne, esimerkit
- 3147
- 796
- Joshua Emmerich
Se globaali proteiinit Ne ovat proteiineja, joilla on tertiäärinen rakenne, jossa peptidiketjut on kiinnitetty globaaliin ulkonäöön. Suuri osa soluproteiineista vastaa tätä ryhmää, proteiinit, joilla on entsymaattinen aktiivisuus, ovat tärkeimpiä.
Proteiinit edustavat hyvin erityistä molekyylityyppiä soluissa, jotka muodostavat kaikki elävät olennot. Sen rakenne koostuu 20 aminohapon yhdistelmästä, joka toistetaan eri mittasuhteissa ja jotka sitoutuvat toisiinsa kemiallisten yhteyksien avulla, geneettisesti määritettyyn järjestykseen tai sekvenssiin.
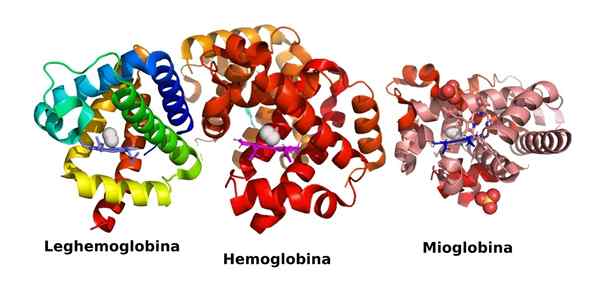 Kolmen happea kuljettavien globaalien proteiinien rakenne: leghemoglobiini, hemoglobiini ja myoglobiini (lähde: Veronica Stafford/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0) Wikimedia Commonsin kautta)
Kolmen happea kuljettavien globaalien proteiinien rakenne: leghemoglobiini, hemoglobiini ja myoglobiini (lähde: Veronica Stafford/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0) Wikimedia Commonsin kautta) Ne ovat erittäin runsaasti ja täyttävät välttämättömät toiminnot monista solujen elämän näkökulmasta, siinä määrin, että ilman niitä elämän olemassaoloa, kuten tiedämme, että se ei olisi mahdollista.
Jokaisella maan päällä asumislajilla on erityinen proteiinisarja ja enemmän.
[TOC]
Globaali ja kuituproteiinit
Proteiinien tutkimukselle omistetut tutkijat ovat perinteisesti luokitelleet ne monien parametrien mukaan, mutta yksi tärkeimmistä on rakenne. Siten niiden omaksuman kolmen dimensionaalisen rakenteen mukaan proteiinit voivat olla kuitumaisia tai globaaleja.
Kuitumaiset proteiinit ovat niitä, joilla on pitkänomainen ulkonäkö, koska niiden peptidiketjut ovat yleensä yhdensuuntaisia toistensa kanssa. Näillä proteiineilla on monia toimintoja, mutta tärkeimmät liittyvät rakenteen, tuen ja solun biomekaniikan kanssa.
Kaksi klassista esimerkkiä ihmiskehon ja muiden eläinten kuituproteiineista keratiini ja kollageeni, jotka osallistuvat hiusten ja kynsien (ensimmäinen) ja ihon, luiden ja jänteiden muodostumiseen (viimeinen).
Globaaliproteiinit puolestaan ovat proteiineja, joilla on pyöristetty tai pallomaisempi kolmiulotteinen konformaatio, joten ne saattavat tuntua hiukan kompaktilta ja epäsäännöllisemmiltä. Nämä proteiinit eivät osallistu suoraan solurakenteesta, mutta niillä on perustavanlaatuinen funktionaalinen rooli.
Voi palvella sinua: Taxism Hemoglobiinirakenne
Hemoglobiinirakenne Esimerkkejä globaaleista proteiineista ovat proteiineja, joilla on entsymaattinen aktiivisuus (entsyymit), kuten hemoglobiini, joka osallistuu hapen kuljetukseen veren läpi ja Immunoglobuliinit, jotka toimivat nisäkkäiden immuunijärjestelmässä.
Globaalien proteiinien ominaisuudet
Liukoisuus
Globaaliproteiinit ovat osittain liukenevia veteen, erittäin tärkeän näkökulman näkökulmaan, koska nämä ovat todella runsaasti sytosolin vesiympäristössä ja eri soluorganien luumenissa, joissa ne käyttävät toimintojaan.
Rakenne
Vaikka kuitumaiset proteiinit muodostuvat melkein aina toistuvalla toissijaisella rakenteella, globaalit proteiinit ovat heterogeenisempiä, koska niille on ominaista esitellä koko peptidiketjuja erityyppisiä sekundaarisia rakenteita, jotka taittavat toisiaan.
Funktiot
Globaalien proteiinien ryhmässä ovat kaikki entsyymejä, suuri määrä kuljetusproteiineja, sääteleviä proteiineja, motorisia proteiineja ja monia muita, joten se on hyvin monimuotoinen ryhmä, sekä rakenteen ja koon ja toiminnan kannalta.
Konformaatio
Kuituproteiinien totta on totta, kaikki tarvittavat tiedot globaalien proteiinien taittumisen ja rakenteellisen konformaation saavuttamiseksi määritetään aminohapposekvenssillä, joka puolestaan riippuu niistä sisältävistä geeneistä, jotka koodaavat geenit.
Luokittelu
Yleensä nämä proteiinit luokitellaan niiden toiminnan mukaan, ja jokainen luokka on myös jaettu moniin alaluokkiin. Hyvä esimerkki tästä on entsyymien luokittelu, joka perustuu tällä hetkellä reaktiotyyppiin, johon he osallistuvat.
Globaalien proteiinien rakenne
Globaaliproteiinit määritellään sellaisenaan niiden tertiääristen rakenteiden alkuperäisen konformaation ansiosta, joissa aminohappiketjut on sijoitettu muodostamaan suhteellisen pallomaisen rakenteen, yleensä verhoiltu hydrofiilisillä aminohapolla (jotka ovat vuorovaikutuksessa veden kanssa), jotka suojaavat hydrofobisempaa ydintä ((jotka ovat vuorovaikutuksessa veden kanssa joka ei ole vuorovaikutuksessa veden kanssa).
Voi palvella sinua: Kasvaimen nekroositekijä (TNF): rakenne, toimintamekanismi, toimintaEnsisijainen ja toissijainen rakenne
Kuten kuitumaiset proteiinit, myös globaalit proteiinit ovat primaarirakenne, jonka muodostuu niistä valmistavien aminarakenteen lineaarisesta ketjusta.
Tertiäärinen ja kvaternäärinen rakenne
Globaalien proteiinien tertiäärinen rakenne muodostuu spontaanisti ja sitä ylläpitää aminohappiketjujen väliset vuorovaikutukset, jotka tekevät niistä.
Se on kompakti ja puoliksi kuoren konformaatio, niin kompakti, että se muistuttaa kristallia. Se määritetään eri sekundaaristen rakenteiden välisillä vuorovaikutuksilla, jotka voivat olla samassa polypeptidiketjussa.
On määritetty, että näiden ketjujen välistä vuorovaikutusta ylläpitävät voimat ovat yleensä heikkoja, kuten van der waals -vuorovaikutukset hydrofobisten aminohappojen (apolaariset sidokset) välillä tai vety sillana hydrofiilisten aminohappojen välillä (polaariset yhteydet (polaariset sillat linkit).
Lisäksi monilla globaaleilla proteiineilla, etenkin suurilla, on erilaisia "lohkoja" tai "domeeneja", joilla voi olla erilaisia toimintoja samassa molekyylissä.
Samoin joitain globaaleja proteiineja löytyy luonnosta suurina proteiinikomplekseina, jotka koostuvat erillisistä (erillisistä) polypeptidiketjuista, jotka tunnetaan myös nimellä Aliyhteydet, Joten sanotaan, että ne ovat proteiineja, joilla on kvaternääriset rakenteet.
Esimerkkejä globaaleista proteiineista
On monia esimerkkejä globaaleista proteiineista, joistakin solujen ja muiden välttämättömyydestä ja toisista ei niin paljon, mutta mikä on, aina sen rakenne liittyy sen toimintaan.
Solutasolla voimme sitten puhua joistakin proteiineista, jotka osallistuvat tärkeimpiin aineenvaihduntareiteihin, kuten:
HEksokinaasi
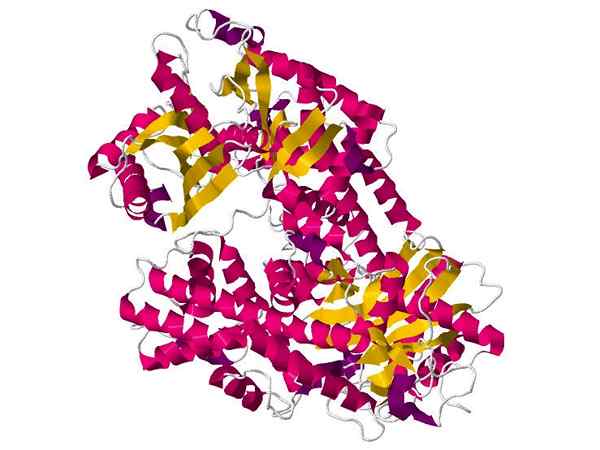 Heksokinaasi
Heksokinaasi Se on suhteellisen pieni globaali proteiini, jota esiintyy melkein kaikissa elävissä soluissa, missä se on vastuussa glukoosijätteen fosforylaatioreaktion katalysoinnista glykolyyttisen reitin ensimmäisessä osassa.
SUccinato -dehydrogenaasi
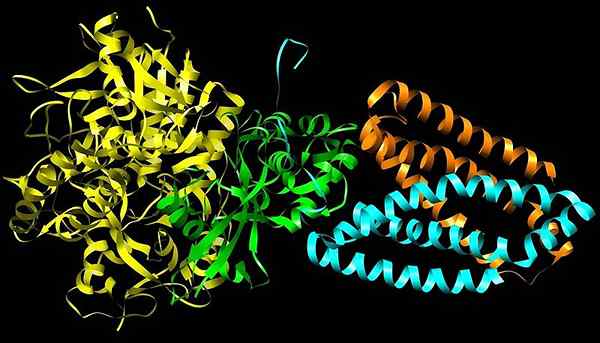 Suuri dehydrogenaasi
Suuri dehydrogenaasi Se on mitokondriaalinen proteiinikompleksi, joka koostuu neljästä alayksiköstä (A-D) ja joka osallistuu sekä trikarboksyylihapposykliin (Krebs-sykli) että elektronikuljetinketjuun, kaksi perusprosessia solun energian tuottamiseksi ATP-muodossa muodossa ATP-muodossa.
Voi palvella sinua: viidakon bioottiset ja abioottiset tekijätIhmiskehossa ja muissa eläimissä on myös muita erittäin tärkeitä proteiineja, kuten hemoglobiini ja immunoglobuliinit.
HEmoglobiini
 Hemoglobiini
Hemoglobiini Se on, kuten sukkinaattidehydrogenaasi, globaali proteiini, jolla on kvaternäärinen rakenne, koska se muodostuu kahdella parilla eri alayksiköitä, joita kutsutaan alfaketjuina ja beetaketjuina. Tämä sijaitsee punasolujen sisällä, missä se osallistuu hapen kuljetukseen kudoksiin.
MIoglobiini
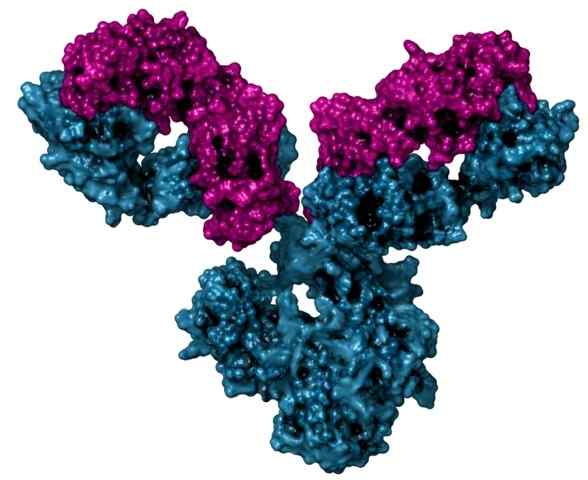 Immunoglobuliinin rakenne, jota kutsutaan myös vasta -aineeksi
Immunoglobuliinin rakenne, jota kutsutaan myös vasta -aineeksi Se on myös globaali proteiini, joka sitoutuu happea, mutta tällä on vain tertiäärinen rakenne ja sitä löytyy yksinomaan selkärankaisten eläinten luuston lihassoluista.
Yllyttäänmunoglobuliinit
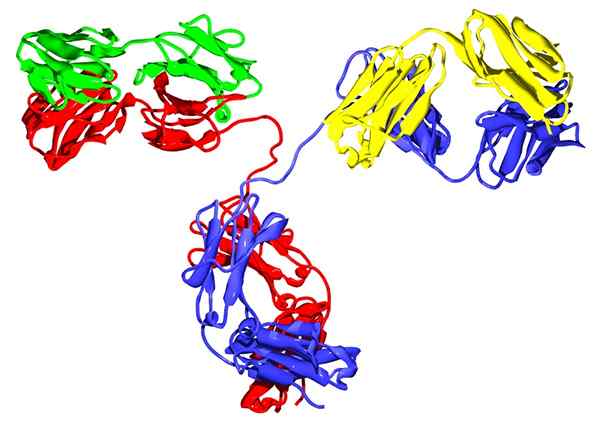 IgG2 -immunoglobuliini
IgG2 -immunoglobuliini Ne ovat globaaleja glykoproteiineja, jotka ovat läsnä monissa eläimissä, etenkin veressä, imusolmukkeissa ja vaskularisoiduissa kudoksissa, joissa ne käyttävät immuunijärjestelmän jäseninä.
Samoin kuin hemoglobiini ja sukkinaattidehydrogenaasi, näillä proteiineilla on kvaternäärinen rakenne, koska ne muodostuvat kahdella alayksiköllä: kaksi raskasta ketjua ja kaksi valoketjua.
Vesiporiini
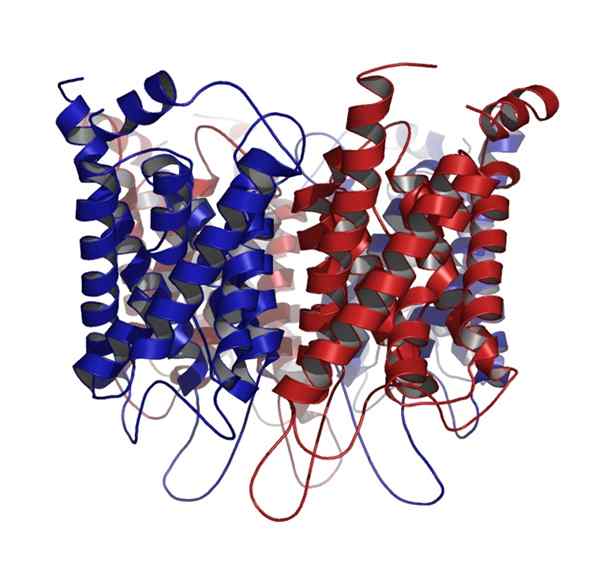 Vesiporiini
Vesiporiini Toinen globaali proteiini, yleinen eläin- ja kasvisoluissa, on proteiini, joka muodostaa kalvokanavat veden kuljetukseen, tunnetaan paremmin nimellä vesiporiini.
Aquaporiinit luokitellaan globaaleiksi proteiineiksi, mutta ne ovat kattavia membraaniproteiineja, jotka on kiinnitetty kvaternäärisiin rakenteisiin, jotka muodostuvat useiden identtisten alayksiköiden muodossa.
Viitteet
- Chan, h. S., & Tilli, k. -Lla. (1990). Rakenteen alkuperä globaalissa proteiineissa. Kansallisen tiedeakatemian julkaisut, 87 (16), 6388-6392.
- Tyytyväinen, k., & Prossa, S. (2007). Immunoglobuliinit.
- Gromiha, m. M. (2010). Bioinformatiikan proteiini: sekvenssistä toimintaan. Akateeminen lehdistö.
- Gromiha, m. M., Nagarajan, r., & Sailvaraj, S. (2019). Bioinformatiikan rakenneproteiini: Yleiskatsaus.
- Nelson, D. Lens., Lehninger, a. Lens., & Cox, M. M. (2008). Lehninger -biokemian periaatteet. Macmillan.
- Verkman a. S. (2013). Vesiporiinit. Nykyinen biologia: CB, 23 (2), R52-R55. https: // doi.org/10.1016/j.Pentu.2012.yksitoista.025

