Vastaavuuspiste

- 1760
- 163
- Louis Moen
 Vastaavuuspiste on stökiometrisesti lisäarvon pitoisuus, joka on yhtä suuri kuin analyytin määrä
Vastaavuuspiste on stökiometrisesti lisäarvon pitoisuus, joka on yhtä suuri kuin analyytin määrä Mikä on vastaavuuspiste?
Hän vastaavuuspiste Se on yksi, jossa kaksi kemiallista ainetta on täysin reagoitu. Happo-emäsreaktioissa tämä piste osoittaa, kun kokonainen happo tai emäs on neutraloitu.
Tämä käsite on jokapäiväinen tilavuusasteessa tai arvostuksissa, ja se määritetään yksinkertaisilla matemaattisilla laskelmilla.
Tältä osin aste on prosessi, jossa tunnetun pitoisuusliuoksen tilavuus lisätään huolellisesti, nimeltään nimellinen, tuntemattomaan pitoisuusliuokseen sen pitoisuuden saamiseksi.
PH -indikaattorin käyttö antaa tietää hetken, jolla aste päättyy. Indikaattori lisätään liuokseen, jonka otsikko on sen pitoisuuden kvantifiointi.
Happo-emäsindikaattori on kemiallinen yhdiste, jonka väri riippuu väliaineen vetypitoisuudesta tai pH: sta.
Indikaattorin värimuutos osoittaa asteen päätepisteen, vaikkakaan ei vastaavuuspistettä. Ihannetapauksessa molempien pisteiden on osuttava, mutta todellisuudessa värinmuutos voi tapahtua muutama tippa happo neutraloinnin tai emäksen jälkeen on saatu päätökseen.
Mikä on vastaavuuspiste?
Pulloon sijoitettujen tuntemattoman pitoisuushappojen liuos.
Indikaattorin valinta on tehtävä siten, että se muuttaa väriä siinä pisteessä.
Tämä on ekvivalenssipiste, kun taas pistettä, jossa indikaattori muuttaa väriä, kutsutaan päätepisteeksi, jossa otsikko päättyy.
Voi palvella sinua: Hypotoninen ratkaisu: Komponentit, valmistelu, esimerkkejäViimeinen kohta
Indikaattorin ionisaatio tai dissosiaatio esitetään seuraavasti:
Hin +h₂o sisään- + H3JOMPIKUMPI+
Ja siksi sillä on vakio ka
Ka = [h3JOMPIKUMPI+] [Sisään-] / [Hin]
Ei -disosioituneen indikaattorin (HIN) ja dissosioituneen indikaattorin välinen suhde (-) Määritä indikaattorin väri.
Hapon lisääminen lisää HIN -pitoisuutta ja tuottaa indikaattorin värin 1. Samaan aikaan pohjan lisääminen suosii dissosioituneen indikaattorin pitoisuuden lisääntymistä (-) (Väri 2).
On toivottavaa, että ekvivalenssipiste on samanaikainen päätepisteen kanssa. Tätä varten indikaattori valitaan värimuutosvälillä, joka sisältää vastaavuuspisteen. Lisäksi kyse on minkä tahansa virheen vähentämisestä, joka tuottaa eron ekvivalenssipisteen ja päätepisteen välillä.
Liuoksen standardisointi tai arviointi on prosessi, jossa ratkaisun tarkka pitoisuus määritetään. Se on metodologisesti tutkinto, mutta noudatettu strategia on erilainen.
Polmiin asetetaan ensisijaisen standardin liuos ja standardisoidun nimellinen liuos lisätään burettiin.
Vahvan hapon titrauksen ekvivalenssi, jolla on vahva emäs
100 ml 0,1 M HCl: tä asetetaan pulloon ja lisätään vähitellen burettin avulla, 0,1 M NaOH -liuoksella, määrittäen suolahapon aiheuttavan liuoksen pH -muutokset.
Alun perin ennen NaOH: n lisäämistä HCL -liuoksen pH on 1.
Vahva emäs (NaOH) lisätään ja pH kasvaa vähitellen, mutta se on edelleen happama pH, koska ylimääräinen happo määrittää tämän pH: n.
Voi palvella sinua: kaliumjodidi (KI): rakenne, ominaisuudet, hankkiminen, käyttö, riskitJos NaOH jatkuu, on aika, jolloin ekvivalenssipiste saavutetaan, missä pH on neutraali (pH = 7). Happo on reagoinut pohjaan kuluttavan pohjan kanssa, mutta pohjaa ei ole vielä ylimääräinen.
Natriumkloridin pitoisuus on vallitseva, joka on neutraali suola (eikä NA+ eikä cl- ovat hydrolysoituja).
Jos NaOH jatkaa, pH kasvaa edelleen, ja muuttuu emäksisemmäksi kuin ekvivalenssipiste, koska NaOH -pitoisuus hallitsee.
Ihannetapauksessa indikaattorin värinmuutoksen tulisi tapahtua pH = 7, mutta tittelikäyrän äkillisen muodon vuoksi voidaan käyttää fenolftaleiinia, joka muuttuu vaaleanpunaiseksi väriin pH: ksi noin 8.
Syksypohjainen heikkopohjainen asekäyrä
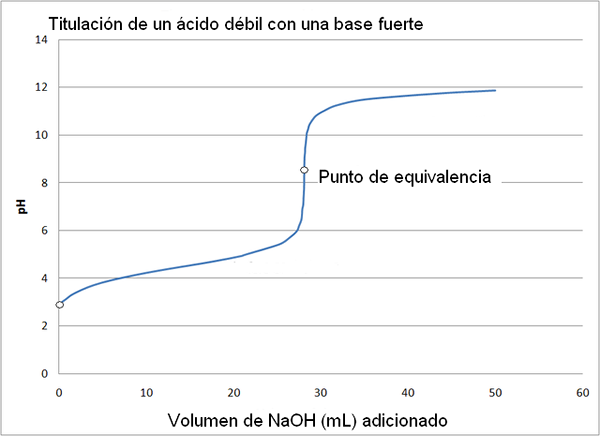 Heikko happo ja vahva emäs titrauskäyrä. Lähde: Wikimedia Commons
Heikko happo ja vahva emäs titrauskäyrä. Lähde: Wikimedia Commons Vahvan hapon titrauskäyrä vahvalla emäksellä on samanlainen kuin ylempi kuva. Ainoa ero molempien käyrien välillä on, että ensimmäisellä on paljon äkillisempi pH.
Tässä tapauksessa heikko happo on nimeltään, kuten etikkahappo (CH3COOH) vahvalla emäksellä, natriumhydroksidilla (NaOH). Reaktio, joka tapahtuu asteessa, voi kaavioida seuraavasti:
NaOH +ch3Cooh => ch3Kujertaa-Naa+ + H₂o
Tässä tapauksessa asetaattipuskuriliuos muodostetaan PKA = 4,74. Tyynytetty alue näkyy pienessä ja melkein huomaamattomassa muutoksessa ennen pH: ta 6.
Se voi palvella sinua: aminoharja (NH2): rakenne, ominaisuudet, esimerkitVastaavuuspiste, kuten kuva osoittaa, on noin 8,72 eikä 7. Tämä johtuu siitä, että Cho3Kujertaa- Se on anioni, jonka jälkeen hydrolysar tuottaa OH-, Mikä perustaa pH:
CH3Kujertaa- + H₂o ch3COOH +OH-
Tasot
Etikkahappo titraus natriumhydroksidilla voidaan jakaa 4 vaiheeseen analysoitavaksi.
- Ennen emäksen (NaOH) lisäämisen aloittamista liuoksen pH on hapan ja riippuu etikkahapon dissosiaatiosta.
- Kun natriumhydroksidia lisätään, asetaatin vaimennusliuos muodostuu, mutta samalla tavalla konjugoituneen asetaattipohjan muodostuminen lisääntyy, mikä tuo mukanaan lisääntyneen liuoksen liuoksen liuoksen liuoksen lisääntymisen.
- Ekvivalenssipisteen pH tapahtuu pH: n 8,72, joka on rehellisesti alkalinen.
Ekvivalenssipisteellä ei ole vakioarvoa ja vaihtelee asteeseen osallistuvien yhdisteiden mukaan.
- Jatkamalla NaOH: n lisäämistä vastaavuuspisteen saavuttamisen jälkeen pH kasvaa ylimääräisen natriumhydroksidin vuoksi.
Indikaattorien valinta vastaavuuspisteen mukaan
Fenolftaleiini on hyödyllinen määritettäessä ekvivalenssipisteen tässä asteessa, koska sen värivaihtopiste on noin 8 pH: ssa, joka kuuluu etikkahapon pH -alueelle, joka sisältää pisteekvivalenssin (pH = 8,72).
Toisaalta metyylipunainen ei ole hyödyllinen ekvivalenssipisteen määrittämisessä, koska se muuttaa väriä pH -aikavälillä 4,5 - 6,4.
Viitteet
- Helmestine, Anne Marie. Ekvivalenssipisteen määritelmä. Toipunut Ajatelukyvystä.com
- Ero päätepisteen ja vastaavuuspisteen välillä. Haettu eroon.netto
- Vastaavuuspiste: Määritelmä ja laskenta. Tutkimus toipunut.com

