Mitkä ovat anodi ja katodi?

- 2648
- 481
- Eddie Hackett
Hän anodi- ja katodi Ne ovat elektrodien tyyppejä, joita löytyy sähkökemiallisista soluista. Nämä ovat laitteita, jotka kykenevät tuottamaan sähköä kemiallisen reaktion kautta. Eniten käytettyjä sähkökemiallisia soluja ovat akut.
Sähkökemiallisia soluja, elektrolyyttisiä soluja ja galvaanisia tai voltaisia soluja on kahta tyyppiä. Elektrolyyttisissä soluissa energian tuottama kemiallinen reaktio ei tapahdu spontaanisti, mutta sähkövirta muuttuu kemialliseksi hapettumisreaktioksi.

Galvaaninen solu koostuu kahdesta puoliksi lodgista. Nämä yhdistävät kaksi elementtiä, metallinen kuljettaja ja suolaliuos.
Sähköjohdin, kuten hänen nimensä osoittaa, johtaa sähköä, koska hänellä on hyvin vähän vastustuskykyä sähkövarauksen liikkeelle. Parhaat kuljettajat ovat yleensä metalleja.
Suolaliuossilta on putki, joka yhdistää kaksi puoliksi -laattia ylläpitäen samalla niiden sähkökosketusta ja antamatta kunkin solun yhdistyksen komponentteja.Jokainen galvaanisen kennon puolimedia sisältää elektrodin ja elektrolyytin.
Kun kemiallinen reaktio tapahtuu, yksi puoliksi -LLADS menettää elektroneja elektrodiinsa hapettumisprosessin kautta; kun taas muut voittaa elektronit elektrodille, pelkistysprosessin kautta.
Hapettumisprosessit tuotetaan anodissa ja katodin vähentämisprosessit
[TOC]
Anodi
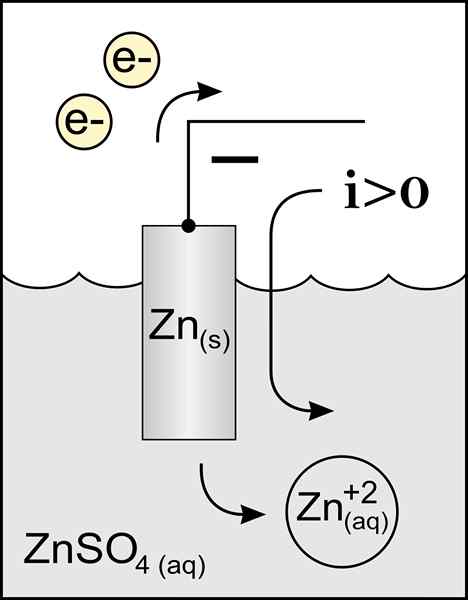 Kaavio sinkkianodista voltaatiskennossa. Lähde: Alkuperäinen teos: Tiedosto: sinkkianodi 2.Käyttäjän PNG: Micheljullian (Talk) johdannainen työ: Kes47/CC BY-S (http: // creativecommons.Org/lisenssit/by-SA/3.0/)
Kaavio sinkkianodista voltaatiskennossa. Lähde: Alkuperäinen teos: Tiedosto: sinkkianodi 2.Käyttäjän PNG: Micheljullian (Talk) johdannainen työ: Kes47/CC BY-S (http: // creativecommons.Org/lisenssit/by-SA/3.0/) Anodin nimi tulee kreikkalaisesta ανά (aná): ylös ja οδός (Odós): Polku. Faraday keksi tämän termin 1800 -luvulla.
Paras määrittelevä anodi on elektrodi, joka menettää elektroneja hapetusreaktiossa. Normaalisti se liittyy sähkövirran kuljetuksen positiiviseen napaan, mutta se ei aina ole tapaus.
Voi palvella sinua: arvostetut ratkaisutVaikka akkuissa anodi on positiivinen napa, LED -valaisimissa se on päinvastainen, anodi on negatiivinen napa.
Normaalisti määritetään sähkövirran tunne, ja se arvostaa sitä vapaiden kuormien tunteena, mutta jos kuljettaja ei ole metallinen, tuotetut positiiviset maksut siirretään ulkoiselle ohjaimelle.
Tämä liike tarkoittaa, että meillä on positiivisia ja negatiivisia varauksia, jotka liikkuvat vastakkaisissa aisteissa, joten sanotaan, että virran suunta on anodissa olevien kationien positiivisten varausten reitti, joka on anodien negatiivinen kuormitus anodit, joita löytyy katodista.
Galvaanisissa soluissa, joilla on metallinen johdin, reaktiossa syntynyt virta seuraa polkua positiivisesta navasta negatiiviseen.
Mutta elektrolyyttisissä soluissa, joilla ei ole metallista johtimen.
Lämpöioniset anodit vastaanottavat suurimman osan katodista tulevista elektroneista, lämmittävät anodin ja on löydettävä tapa hävittää. Tämä lämpö syntyy jännityksessä, joka tapahtuu elektronien välillä.
Erikoisanodit
On tyyppisiä erityisiä anodeja, kuten x -rakoissa. Näissä putkissa elektronien tuottama energia tuottaa X -rakoja tuottaen suurta energiaa, joka lämmittää anodia.
Tämä lämpö tapahtuu erilaiseen jännitteeseen molempien elektrodien välillä ja tämä painostaa elektroneja. Kun elektronit liikkuvat sähkövirrassa, ne osuvat anodiin lähettämällä lämmönsä.
Voi palvella sinua: Henderson-Haselbalch -yhtälö: Selitys, esimerkit, liikuntaKatodi
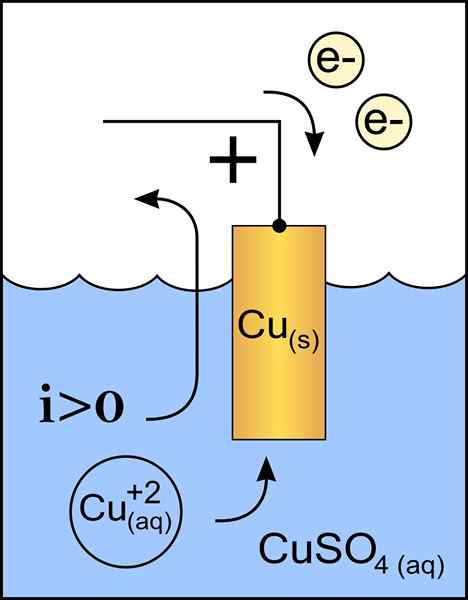 Kuparikatodikaavio voltaatiskennossa. Lähde: Alkuperäinen teos: Tiedosto: sinkkianodi 2.Käyttäjän PNG: Micheljullian (Talk) johdannainen työ: Kes47/CC BY-S (http: // creativecommons.Org/lisenssit/by-SA/3.0/)
Kuparikatodikaavio voltaatiskennossa. Lähde: Alkuperäinen teos: Tiedosto: sinkkianodi 2.Käyttäjän PNG: Micheljullian (Talk) johdannainen työ: Kes47/CC BY-S (http: // creativecommons.Org/lisenssit/by-SA/3.0/) Katodi on negatiivisen kuormituksen elektrodi, joka kemiallisessa reaktiossa on pelkistysreaktio, jossa sen hapettumistila vähenee, kun se vastaanottaa elektroneja.
Kuten anodi, Faraday ehdotti termiä katodi, joka tulee kreikkalaisesta κατά [catá]: 'Down' ja ὁδός [Odós]: 'Road'. Tähän elektrodiin negatiivinen kuorma annettiin ajan myötä.
Tämä lähestymistapa oli väärä, koska sen sijaitsevasta laitteesta riippuen siinä on kuorma tai toinen.
Tämä suhde negatiiviseen napaan, kuten anodin kanssa, johtuu oletuksesta, että virta virtaa positiivisesta navasta negatiiviseen. Tämä syntyy galvaanisen solun sisällä.
Elektrolyyttisissä soluissa energian siirtovälineet, kuten se ei ole metallissa, vaan elektrolyytissä, voi olla samanaikaisesti negatiivisia ja positiivisia ioneja, jotka liikkuvat vastakkaisissa aisteissa. Mutta sopimuksella sanotaan, että virta menee anodista katodiin.
Erikoiskatodit
Tyyppiset spesifiset katodit ovat termionisia katodeja. Näissä katodi säteilee elektroneja lämmön vaikutuksen vuoksi.
Termionisissa venttiileissä katodi voi lämmittää itse kiertämällä lämmitysvirta filamenttiin, jonka se on kytketty siihen.
Tasapainotus reaktio
Jos otamme galvaanisen solun, joka on yleisin sähkökemiallinen solu, voimme muotoilla generoituneen tasapainoreaktion.
Jokaisella galvaanisen solun muodostavassa puoliaidialla on ominainen jännitys, joka tunnetaan pelkistyspotentiaalina. Jokaisessa puoliksi -mediassa on hapettumisreaktio eri ionien välillä.
Voi palvella sinua: absorptiospektriKun tämä reaktio saavuttaa tasapainon, solu ei voi tarjota enemmän jännitystä. Tällä hetkellä kyseisen hetken puolimediassa tapahtuva hapettumisella on positiivinen arvo lähempänä on tasapaino. Reaktion potentiaali on suurempi, sitä enemmän tasapainoa se saavutetaan.
Kun anodi on tasapainossa, se alkaa kadottaa kuljettajan läpi kulkevan elektronit katodiin.
Katodissa pelkistysreaktio tapahtuu, sitä edelleen mahdollisimman tasapainon reaktio on anodista tulevia elektroneja ja ottaen elektroneja.
Viitteet
- Huheey, James ja., et al.Epäorgaaninen kemia: Rakenteen ja reaktiivisuuden periaatteet. Pearson Education India, 2006.
- Sienko, Michell J.; Robert, a.Kemia: Periaatteet ja ominaisuudet. New York, Yhdysvallat: McGraw-Hill, 1966.
- Brady, James ja.Yleinen kemia: Periaatteet ja rakenne. Wiley, 1990.
- Petrucci, Ralph H., et al.Yleinen kemia. Inter -American Educational Fund, 1977.
- Masterton, William L.; Hurley, Cecile n.Kemia: Periaatteet ja reaktiot. Cengage Learning, 2015.
- Charlot, Gaston; Tremillon, Bernard; Badoz-Lambling, J. Sähkökemialliset reaktiot. Toray-Masson, 1969.

