Radikaalit vuokraavat kuinka ne muodostavat, nimikkeistö, esimerkkejä

- 3161
- 376
- Eddie Hackett
Se Radikaalit vuokra Ne ovat joukko epävakaita molekyylejä, jotka ovat peräisin alkaanin hydrogien menetyksestä. Niille on ominaista kadonnut elektroni, joten ne reagoivat nopeasti atomin Valencian oktetin loppuun.
Näitä radikaaleja symboloidaan kirjaimella R, samoin kuin vuokraryhmät, mutta eron, jonka piste lisätään, r ·. Tämä kohta osoittaa elektronin läsnäolon katosi. Harkitse esimerkiksi metaanikaasua, Cho4. Tämä alkaani, joka menettää yhden hydrogeneistaan, muuttuu radikaaliksi metyyliksi, Cho3· (Kuva alla).
 Radikaalin alkyylin ja radikaalin metyylin yleinen kaava. Lähde: Gabriel Bolívar Molviewin kautta.
Radikaalin alkyylin ja radikaalin metyylin yleinen kaava. Lähde: Gabriel Bolívar Molviewin kautta. Jos haluat syventää vähän radikaalista rakenteesta CH3·, Nähdään, että sen kadonnut elektroni on kulmassa kohtisuorassa C-H-linkkeihin nähden; eli se sijaitsee kiertoradalla p puhdas. Siksi CHO3· Hyväksy SP -hybridisaatio2, samoin kuin yleensä muiden radikaalien kanssa alkyyli.
Nämä radikaalit ovat ketjureaktioiden kulmakivi, johon alkaanit osallistuvat, samoin kuin niiden halogenointi: klooraus, bromaatio jne. Siellä on 1., 2. ja 3. radikaali, samoin kuin vinyyli ja alilic, joista jokaisella on stabiilisuus ja koulutuksen helppous.
[TOC]
Kuinka radikaalit muodostuvat alkyyli?
"Yksinkertaisempi" reaktio, jolle radikaalit muodostuvat, on alkaanien halogenointi. Muodostumiseksi on annettava ketjureaktio, joka tapahtuu vain korkeissa lämpötiloissa (yli 250 ºC) tai ultraviolettivalon esiintyvyyden alla huoneenlämpötilassa.
Voi palvella sinua: natriumsulfiitti (Na2SO3)Harkitse metaanin kloorausta yhdessä edellä mainituissa olosuhteissa:
Cl2 → 2CL ·
Tarjottu energia riittää katkaisemaan kloorimolekyylin CL-CL-linkin, joka esiintyy homoliittisen tauon; eli jokainen klooriatomi pysyy yhden linkkielektronien kanssa. Siksi muodostuu kaksi radikaalia.
Sitten radikaali CL · hyökkää metaanimolekyyliin:
Cl · + ch4 → HCl + CH3·
Ja radikaali metyyli ilmestyy. Tämä ch3· Se on melko epävakaa, joten se reagoi heti voittamaan ylimääräisen elektronin, jonka kanssa se näyttää sen yksinäisestä elektronista:
CH3· + Cl2 → ch3Cl + Cl ·
Muodostunut reagoi toisen metaanimolekyylin kanssa ja sykli toistetaan uudestaan ja uudestaan. Kun metaani loppuu, tapahtuu seuraavat reaktiot, jotka lopettavat ketjureaktion:
Cl · + · Cl → Cl2
CH3· + · Cho3 → ch3CH3
CH3· + · Cl → ch3Cl
Suhteellinen vakaus
CH3
Metaani ei ole ainoa alkaani, joka on "radikalisoitu" kloorauksen avulla. Se tapahtuu myös samalla etaanin, propaanin, butaanin ja muiden isomeerien kanssa. Se, mikä vaihtelee, on kuitenkin välttämätön energia, joka on annettava siten, että radikaalit cl · dehydrogatiivit alkaanin molekyyli. Metyyliradikaalin tapauksessa se on erittäin epävakaa ja siksi vaikea muodostaa.
Siten radikaali Cho3CH2· Se on vakaampi ja helppo muodostaa kuin Cho3·. Koska? Koska radikaali ch3CH2· Se on ensisijainen, 1., mikä tarkoittaa, että kadonnut elektroni on hiiliatomilla, joka on kytketty toiseen hiileen. Sillä välin Cho3Heti kun se on kytketty vetyatomiin.
Voi palvella sinua: Fluori: Historia, ominaisuudet, rakenne, hankkiminen, riskit, käytötMitä tämä on? Muistaen edellisen esityksen, kadonnut elektroni sijaitsee kiertoradalla p, kohtisuorassa muihin linkkeihin nähden. CH: ssa3·, Vetyatomit tuskin lahjoittavat elektronisen tiheyden hiiliatomiin yrittäessään kompensoida toisen elektronin puutteen.
Ensimmäinen
CH: ssa3CH2· Toisaalta hiili kadonneella elektronilla on kytketty kahteen vetyyn ja metyyliryhmään. Tämän seurauksena tämä hiili saa suuremman elektronisen tiheyden, mikä auttaa stabiloimaan elektronia. Sama selitys on voimassa muille 1. alkyndiradikaaleille.
Toinen
Radikaalissa sekundaarissa tai toisessa alquilissa, kuten isopropiiliradikaalissa, (ch3-A2C. Siksi se on stabiilempi kuin ensimmäinen ja metyyliradikaalit.
Kolmas
Meillä on myös tertiäärinen tai kolmas alkyndiradikaalit, kuten ter-butyyliradikaali3-A3C ·. Nämä ovat vakaampia kuin 1. ja 2. Nyt on olemassa kolme hiilihapotettua ryhmää, jotka ovat erilaisia kuin vetyatomi, jotka stabiloivat kadonnut elektronin.
Allyyli ja vinyyli
On myös syytä mainita allyyliradikaalit, Cho2= Ch-ch2· Ja vinyyli, Cho2= Ch ·.
Alilic on vakain kaikista. Tämä johtuu siitä, että kadonnut elektroni pystyy jopa siirtymään toisen pään hiiliatomiin. Vínilico puolestaan on kaikkein epävakaa, koska CHO -ryhmä2=, enemmän happoa, houkuttelee elektronista tiheyttä itseään kohti sen sijaan, että luovuttaisi sitä kohti hiiltä elektronin kanssa.
Voi palvella sinua: Lyijyhydroksidi: rakenne, ominaisuudet, käytöt, riskitYhteenvetona voidaan todeta
Alilo> 3. 2nd> 1. 1. vinyyli
Nimikkeistö
Radikaalien alkyylin nimikkeistö on sama kuin korjaavalle. Siten Cho3CH2· Kutsutaan etyyliradikaaliksi; ja radikaali ch3CH2CH2CH3, n-butyyli.
Pääradikaalit vuokraavat
Tärkeimmät alkyyliradikaalit ovat samat alkyyliryhmiä: ne ovat alle kuusi hiiliatomia. Siksi radikaalit ovat johdettu metaanista, etaanista, propaanista, butaanista ja pentanosta ovat yleisimmät. Samoin radikaali vinyyli ja alilicos ovat osa tätä luetteloa.
Muita alkynd -radikaaleja, joita löytyy harvemmin, ovat ne, jotka johtuvat sykloalcanosista, kuten syklobutane, syklobutane tai syklopentano.
Seuraavassa kuvassa useita näistä radikaaleista on esitetty määritetyillä kirjaimilla:
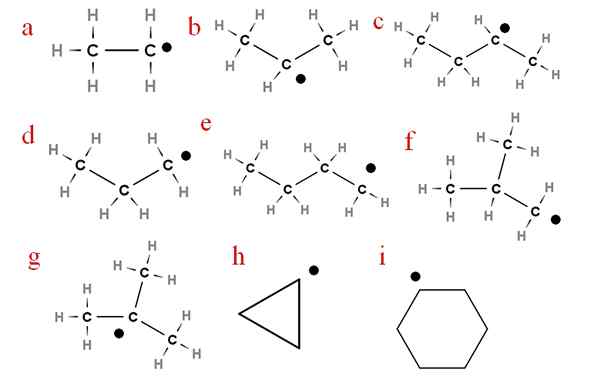 Yhdeksän tärkeintä alkeriaradikaalia. Lähde: Gabriel Bolívar.
Yhdeksän tärkeintä alkeriaradikaalia. Lähde: Gabriel Bolívar. Alkaen kirjaimella 'A', meillä on:
-A, etyyliradikaali
-B, isopropyyliradikaali
-C, Secbutyyliradikaali
-D, radikaali propyyli
-E, radikaali n-butyyli
-F, isobutil radikaali
-G, ter-butyyliradikaali
-H, radikaali cycropilus
-Minä, radikaali sykloheksili
Jokainen näistä radikaaleista voi tai ei ehkä ole hydrogeja korvattu muilla ryhmillä, joten ne ovat yhtä vaihtelevia kuin alkaanit ja niiden rakenteelliset isomeerit.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10. painos.-A. Wiley Plus.
- Wikipedia. (2020). Alkyyli. Haettu: vuonna.Wikipedia.org
- Kemian librettexts. (5. kesäkuuta 2019). Alkyyliradikaalien rakenne: Hyperkonjugaatio. Palautettu: Chem.Librettexts.org
- « Ristiviittauskonsepti, toiminnot, esimerkit
- Vesieläinten ominaisuudet, hengitys, tyypit, esimerkit »

