Eksoterminen reaktio
- 849
- 235
- Shawn Stanton II
Selitämme, mitkä eksotermiset reaktiot, niiden ominaisuudet, erot endotermisten reaktioiden kanssa ovat ja annamme useita esimerkkejä
Mitkä ovat eksotermiset reaktiot?
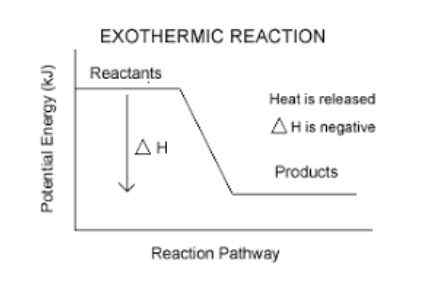
Se eksotermiset reaktiot Ne ovat kemiallisia reaktioita, jotka vapauttavat energiaa lämmön muodossa. Exoterminen sana muodostuu "Ekso" mikä tarkoittaa "ulos" ja "termospullo" mikä tarkoittaa lämpöä, niin "eksoterminen reaktio" tarkoittaa kirjaimellisesti, reaktiota, jossa lämpö sammuu.
Nämä reaktiot ovat hyvin yleisiä ja löydämme ne kaikkialta, kodistamme soluihin, jotka ovat osa kehomme.
Kotona löydämme ne keittiöstä, kun kaasu palaa sarveen ruoan keittämiseksi. Löydämme ne myös automoottoreissa, kun ne polttavat polttoainetta.
 Esimerkki eksotermisestä reaktiosta
Esimerkki eksotermisestä reaktiosta Toisaalta eksotermiset reaktiot ovat välttämättömiä elämälle, koska ne tarjoavat soluille energiaa, jota he tarvitsevat elää, kasvaa ja lisääntyä.
Eksotermisten reaktioiden ominaisuudet
Ne vapauttavat energiaa lämmön muodossa
Tämä on pääominaisuus, joka tekee niistä eksotermisiä reaktioita.
Vapautettu energia tulee samoista reagensseista
Jokainen kemiallinen reaktio vaatii jonkin verran aktivointienergiaa. Eksotermisten reaktioiden tapauksessa tämä energia tulee samoista reagensseista, kun ne muutetaan tuotteiksi.
Exotermiset reaktiot Tuotteet ovat aina stabiilia kuin reagenssit.
Reagenssit tulemalla tuotteiksi, menettävät osan energiastaan lämmön muodossa. Tästä syystä tuotteet pysyvät aina vähemmän energiaa kuin reagenssit, mikä tekee niistä vakaampia.
Heillä on negatiivinen entalpian variaatio.
Tämä on helppo tapa tietää, onko reaktio eksoterminen vai ei. Mikä tahansa reaktio, jolla on AH (lue delta h) negatiivinen, ovat eksoterminen.
- Esimerkiksi, Butaanin (keittiössä polttaman kaasun) palamisreaktiolla on entalpian vaihtelu -11.823 kcal/mol. Siksi se on eksoterminen reaktio.
Ne tarvitsevat laukaisun vain useimmissa tapauksissa.
Monet eksotermiset reaktiot tarvitsevat vain jotain, joka antaa heille tarpeeksi energiaa aloittaa. Tämän jälkeen sama lämpö, jonka he vapauttavat, riittää pitämään reaktion kävely.
- Esimerkiksi, Polttamalla kaasua tarvitaan vain yksi kipinä, sitten liekki jatkuu, kunnes kaasu on ohi.
Eroja eksotermisten reaktioiden ja endotermisten reaktioiden välillä
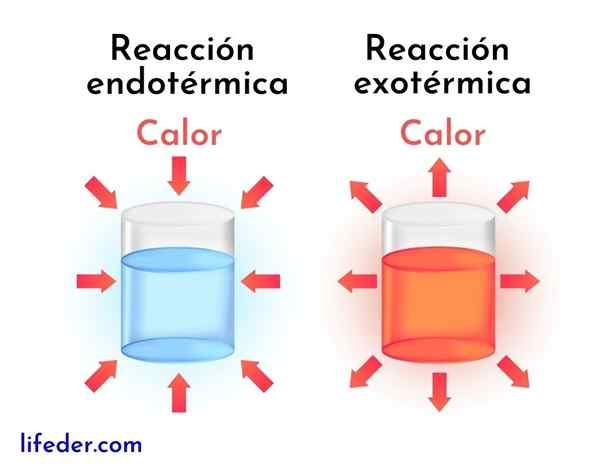
Eksotermiset reaktiot ovat vastakohta endotermisille reaktioille. Jälkimmäisessä reagenssit absorboivat energiaa lämmön muodossa sen vapauttamisen sijasta, kuten eksotermisissä reaktioissa.
Seuraavaksi esitetään pääerot eksotermisten ja endotermisten reaktioiden välillä:
Eksotermiset reaktiot | Endotermiset reaktiot |
Ne vapauttavat energiaa lämmön muodossa. | Ne imevät energiaa lämmön muodossa. |
Heillä on negatiivinen entalpian variaatio, eli DH<0. | Heillä on positiivinen entalpian variaatio, eli dh> 0. |
Niillä on taipumus nostaa ympäröivää lämpötilaa. | Niillä on taipumus vähentää lämpötilaa tai jäähtyä ympäri. |
Reaktiokävelyn pitävä energia tulee samoista reagensseista. | Reaktiokävelyn energia tulee ympäristöstä. |
Vakaampia tuotteita saadaan aina vähemmän energialla. | Vähemmän vakaat tuotteet saadaan aina korkeammalla energiatasolla. |
Esimerkkejä eksotermisistä reaktioista
Keittiön kaasun palaminen
Useimmissa maailman kodeissa ruoan keittämiseen käytetty kaasu on butaani, jolla on molekyylinen kaava C4H10. Tämä hiilivety poltetaan ilman happea seuraavan palamisreaktion avulla, joka vapauttaa suuria määriä lämpöä:
Voi palvella sinua: yksinkertainen mikroskooppi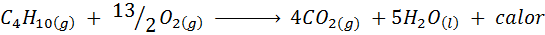
Dynamiitin räjähdys
Dynamite sisältää räjähteen nimeltä nitroglyseriini (C3H5N3JOMPIKUMPI9-A. Tämä yhdiste hajoaa erittäin väkivaltaisesti vapauttaen suuria määriä lämpöä, mikä aiheuttaa suuren räjähdyksen. Kemiallinen reaktio on:
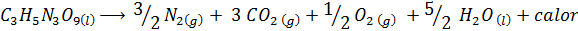
Tällä reaktiolla on a ΔH = -368 kcal⁄mol, Joten se on eksoterminen reaktio.
Valkoisen fosforin spontaani palaminen
Fosforielementti (P) voidaan löytää punaisena fosforina tai valkoisena fosforina. Valkoinen fosfori. Reaktio on:
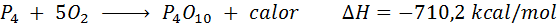
Solujen hengitys
Solujen hengitys on eksoterminen kemiallinen reaktio, joka koostuu syömämme ruoan hapettumisesta. Solut käyttävät tämän reaktion vapauttamaa lämpöä loputtomien endotermisten kemiallisten reaktioiden suorittamiseen, jotka vaativat energian esiintymistä.
Ilotulitus
Ilotulitus sisältää mustan rutkuksen pääosan räjähtävänä komponenttina. Ruutto. Lämpö, jonka tämä reaktio vapautuu, tuottaa laajan värivalikoiman, jonka näemme taivaassa, kun ilotulitus räjähtää.
Kemiallinen lämpöalusta
Lämpötyynyjä käytetään kuumina kompressioina urheiluvammojen lievittämiseksi. Ne koostuvat suljetusta pussista, joka sisältää vettä ja kemisti pienen putken sisällä. Kun putki on rikki, kemisti sekoitetaan veden kanssa, joka tuottaa eksotermisen kemiallisen reaktion, joka lämmittää tyynyn.
Metallinen natriumreaktio veden kanssa
Natrium (NA) on erittäin reaktiivinen alkalinen metalli, joka saapuessaan veden kanssa reagoi väkivaltaisesti vapauttaen paljon lämpöä ja kaasumaista vetyä. Reaktio on:
Se voi palvella sinua: Heterogeenisten seosten erottamismenetelmät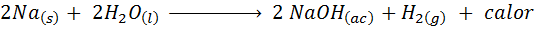
Tämä reaktio vapauttaa 1900 kaloria jokaiselle grammalle NA: sta, joka reagoi veden kanssa. Tämä tarkoittaa, että 1 gramma natriumia riittää 3 keskipitkän kahvikupin lämmittämiseen.
Pesuaineen liukeneminen
Tämä on reaktio, jonka kuka tahansa voi kokea kotonaan. Kun otat kourallisen pölyjäpesuainetta vaatteiden pesemiseksi ja märkällä pienellä vedellä, käsi tuntuu heti kuumalta. Tämä johtuu siitä, että veden pesuaineen liukenemisprosessi on eksoterminen.
Trimita -reaktio
Termita on seos alumiinia erittäin hienon jauheen ja toisen metallin oksidin muodossa. Kipinän jälkeen reaktio on:
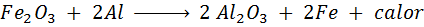
Tämä reaktio vapauttaa niin paljon lämpöä, joka kykenee sulamaan rautaa ja sitä käytetään paljon hitsausjunien hitsaamiseen.
Vesikonsenssi
Kaikille aineille kaasufaasimuutokset (kondensaatio), nestemäiset kiinteät (kiinteytyminen) ja kiinteä kaasu (laskeuma), vapauttavat aina lämpöä ja ovat siksi eksotermisiä prosesseja. Veden tapauksessa vain 18 gramman veden tiivistyminen vapauttaa noin 10.000 kaloria, mikä riittää lämmittämään 15 pientä kahvikuppia.
Viitteet
- Chang, R. ja Goldsby, k. (2014). Kemia. 11. ed. New York: McGraw-Hill Education.
- Exoterminen reaktio (2020, 19. joulukuuta). Wikipediassa. Otettu.Wikipedia.org
- Holmes, W. S. (1963). Fosforin palamislämpö ja P4O10: n ja H3PO4: n muodostumisen entalpit. Faraday Soc. 58. 1916-1925. Doi: 10.1039/TF9625801916.
- Prada p. a., F. Yllyttää. (2014). Sähinkäiset, raketit ja paljon kemiaa. Kemiallinen koulutus. 44-51. Doi: 10.2436/20.2003.02.134
- Lämpöreaktio. Minnesotan yliopisto (kemian laitos). Otettu kemista.Umn.Edu

