Eksotermiset ja endotermiset reaktiot
- 2885
- 341
- Mr. Clifford Kshlerin
 Palaminen on esimerkki eksotermisestä reaktiosta, koska se vapauttaa lämpöä. Ice sulaa puolestaan endotermisen reaktion kautta, koska se vaatii lämpöenergiaa
Palaminen on esimerkki eksotermisestä reaktiosta, koska se vapauttaa lämpöä. Ice sulaa puolestaan endotermisen reaktion kautta, koska se vaatii lämpöenergiaa Se eksotermiset ja endotermiset reaktiot Ne eroavat toisistaan tosiasiassa, että ensimmäinen vapauttaminen lämpöenergiaa, kun taas jälkimmäinen absorboi sen kemiallisten reaktioiden aikana tapahtuvien lämpömuutosten mukaan.
Samoin muun tyyppiset energiatyypit voivat olla mukana kemiallisissa reaktioissa, koska toisinaan reaktion aikana tuotetaan reaktion, valon energiaa, äänenergiaa ja jopa sähköä.
Kemialliset reaktiot luokitellaan lukuun exergoninen ja Endermanics. Exergoninen reaktio vapauttaa energiaa tuotettaessa, kun taas endegonic imee sen.
Tässä tapauksessa eksoterminen reaktio on myös eksergoninen reaktio, koska se vapauttaa lämpöä. Yksi tutuimmista esimerkeistä on palaminen. Joka kerta kun puupala poltetaan, kalori ja kirkas energia vapautuu.
Toisaalta yksi tunnetuimmista enterivisistä kemiallisista reaktioista tapahtuu jääkuution sulamisen yhteydessä, koska jää absorboi ympäristön lämpöenergiaa muuttumaan nestemäiseksi vedeksi.
Eksoterminen reaktio voi tapahtua spontaanisti, vaikka joskus sinun on tehtävä työtä aloittaaksesi. Endotermisen reaktion esiintymiseksi on kuitenkin aina välttämätöntä, että ympäristö on tehnyt työtä järjestelmässä.
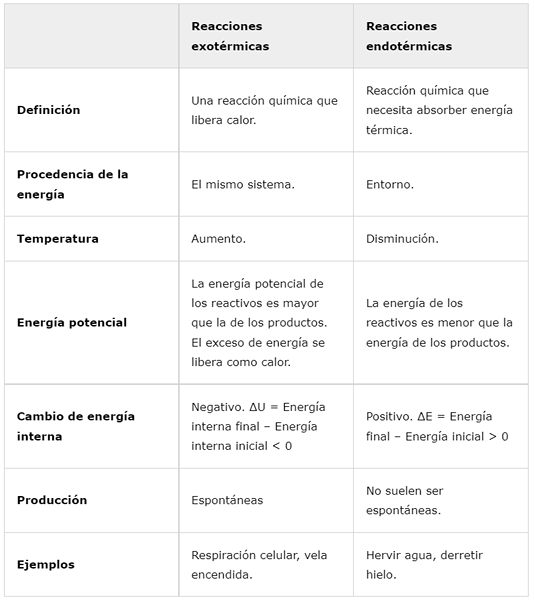
Eksotermiset reaktiot | Endotermiset reaktiot | |
Määritelmä | Kemiallinen reaktio, joka vapauttaa lämpöä. | Kemiallinen reaktio, jonka on absorboida lämpöenergia. |
Energian alkuperä | Sama järjestelmä. | Noin. |
Lämpötila | Lisääntyä. | Vähentää. |
Mahdollinen energia | Reagenssien potentiaalinen energia on suurempi kuin tuotteiden energia. Ylimääräinen energia vapautuu lämmönä. | Reagenssien energia on pienempi kuin tuotteiden energia. |
Sisäinen energian muutos | Negatiivinen. ΔU = Lopullinen sisäinen energia - alkuperäinen sisäinen energia < 0 | Positiivinen. ΔE = lopullinen energia - alkuenergia> 0 |
Tuotanto | Spontaani | Ne eivät yleensä ole spontaaneja. |
Esimerkit | Solujen hengitys, kynttilä polttava. | Keitä vettä, sulaa jäätä. |
Eksotermiset reaktiot
Määritelmä
Kemiallisen reaktion tyyppi, joka vapauttaa lämpöä, kun se suoritetaan.
Se voi palvella sinua: syklohexen: rakenne, ominaisuudet, synteesi ja käyttöEnergian alkuperä
Sama järjestelmä tarjoaa energiaa niin, että reaktio tapahtuu.
Lämpötila
Reaktion jälkeen on a lisääntyä lämpötila.
Mahdollinen energia
Kun reagenssien välillä tapahtuu kemiallinen reaktio, niiden välillä muodostuu linkkejä uusien molekyylien luomiseksi. Mutta kaikki linkit eivät yhdistä atomeja ja molekyylejä samalla voimalla, joten energiaa rikkoa tai luoda jokainen linkki on erilainen.
Jokaisen reaktion aikana ne rikkovat ja luovat erilaisia linkkejä, joten energia on erilainen. Eksotermisessä reaktiossa reagenssien potentiaalinen energia on vanhempi kuin tuotteiden energia ja koska energia säilyy, ylimääräinen vapautuu lämmönä.
Sisäinen energian muutos
Sisäinen energia liittyy järjestelmän kykyyn suorittaa työtä ja sisältää sen potentiaalisen energian ja kineettisen energian. Järjestelmän absoluuttista energiaa ei määritetä, vaan sen variaatio, nimeltään ΔU.
Edellisessä osassa sanotun mukaan sisäisen energian muutos on negatiivinen.
ΔU = lopullinen sisäinen energia - alkuperäinen sisäinen energia < 0
Tuotanto
Useimmat eksotermiset reaktiot ovat spontaani, toisin sanoen ne tapahtuvat itselleen ilman tarvetta lisätä ulkoista energiaa, kunnes reagenssit ovat uupuneet.
Esimerkit
Normaalisti hapettumisreaktiot ja ne, jotka johtavat yhdisteen muodostumiseen, ovat yleensä eksotermisiä reaktioita:
1. Liuottaa pesuaine veteen
Kun se liuottaa vaatteiden pölyä pieneen kylmään veteen, hän tuntuu lämpimältä koskettaessaan sitä.
2. Solujen hengitys
Eläimissä ja kasveissa solujen hengitysprosessi suoritetaan osana hiilisykliä. Hengitys käyttää glukoosia ja happea hiilidioksidin, veden ja energian palauttamiseen reaktion mukaan:
Voi palvella sinua: titaanioksidi (IV): rakenne, ominaisuudet, käyttötarkoituksetC6H12JOMPIKUMPI6 + Kuudes2 → 6Co2 + H2O + energia (ATP)
3. Palava kynttilä
Valon lisäksi palava kynttilä antaa lämpöä ja muita aineita:
Happea happi → vesi + hiilidioksidi + valo ja lämpö
4. Pommituskuoriainen
Tämä hyönteinen puolustaa itseään sirottamalla aerosolia petoeläimistään. Kovakuoriainen pitää nesteitä ja entsyymejä erillisissä osastoissa, jotka sijaitsevat sen vatsassa.
Uhanalaisena se karkottaa nesteet kohti entsyymiosastoa ja kemiallista reaktiota, joka tuottaa höyryä ja lämpöä.
5. Teräs- ja etikkavila
Raudan kaltainen metalli hapettuu hitaasti reagoidessaan ympäristön kanssa, mutta jos etikkaa lisätään pieneen teräsvillaan, havaitaan, että hapettuminen on paljon nopeampaa ja samalla se tuottaa lämpöä.
Endotermiset reaktiot
Määritelmä
Reaktiot, joissa reagenssien on absorboitava lämpöenergia siten, että tuotteet saadaan.
Energian alkuperä
Suoritettavan reaktion välttämätön energia etenee ympäristöstä.
Lämpötila
Endoterminen reaktio edellyttää a vähentää lämpötila.
Mahdollinen energia
Toisin kuin mitä tapahtuu eksotermisen reaktion kanssa, reagenssien energia Se on vähemmän että tuotteiden energia.
Sisäinen energian muutos
Endotermisessä reaktiossa sisäisen energian muutos on positiivinen.
ΔE = lopullinen energia - alkuenergia> 0
Siksi lopullinen energia on suurempi kuin alkuperäinen.
Tuotanto
Endotermiset reaktiot vaativat, että järjestelmän työ tehdään, joten ne eivät yleensä ole spontaaneja.
On kuitenkin joitain endotermisiä reaktioita, kuten jään sulaminen ja tiettyjen nesteiden haihtuminen, jotka ovat spontaaneja huoneenlämpötilassa.
Sitten päätellään, että ympäristön lämpötila on määräävä tekijä kemiallisen reaktion spontaanisuudessa.
Se voi palvella sinua: kemialliset indikaattorit: mitkä ne ovat, tyypit, esimerkitEsimerkit
Monet suolojen liukenemisen ja yleensä aineen hajoamisen reaktioista ovat yleensä endotermisiä. Samalla tavalla jääen siirtyminen nestemäiseen veteen ja höyryn nestemäisen veden, toisin sanoen tilan muunnokset, ovat myös endotermisiä reaktioita.
1. Fotosynteesi
Kasvit suorittavat kemiallisen reaktion auringonvalon läsnä ollessa, jossa ne muuntavat hiilidioksidin ja veden glukoosiksi ja happeaksi. Klorofylli on keskeinen molekyyli tässä prosessissa, jonka kemiallinen reaktio on:
Light + 6Co2 + H2O → c6H12JOMPIKUMPI6 + Kuudes2
Kuten voidaan nähdä, se on hengityksen käänteinen reaktio. Kilogramman glukoosin tuottamiseksi tarvitaan 15 mega -aurinkoenergian joulia.
2. Keitä vettä ja keitä
Hyvin yleinen reaktio, joka vaatii energiaa etenemiseksi, on kiehuvaa vettä:
H2O (neste) + energia → h2O (höyry)
Ruoat vaativat yleensä vettä ruoanlaittoon, ja samalla tavalla niiden sisältämän veden täytyy haihtua niiden keittämiseksi, johon liittyy valtion muutosta.
3. Sulata jää
Samoin on yleistä, että jää sulaa huoneenlämpötilassa, jos tämä on suurempi kuin 0 ° C:
H2O (kiinteä) + energia → h2O (neste)
Siksi juoma jäähtyy lisäämällä jäätä, koska se imee energian, joka tarvitaan tilan muuttamiseen nesteestä.
4. Kylmät pussit
Niitä käytetään mustelmien ja iskujen hoitamiseen. Sisältää vettä ja kirjekuoren ammoniumkloridilla. Kun napautat pussia, kirjekuori on rikki ja ammoniumkloridin reaktio vedellä, joka on endoterminen, jäähdyttää pussin ja lievittää kipua.
5. Otsonituotanto
Auringon ultraviolettisäteily muuttaa happea otsoniksi, vapauttaen lämpöä prosessissa.
Kolmas2 (kaasu) + ultraviolettivalo → 23 (kaasu)
Viitteet
- Byju. Ero edotermisen ja eksotermisten reaktioiden välillä. Byjus.com
- Chang, R. (2013). Kemia. 11Va. Painos. McGraw Hill -koulutus.
- Grelane. Eksotermiset reaktiot lämmityksiin. Toipunut: Grelane.com.
- Hein, m. (2014). Korkeakoulukemian perusteet. Viiva.
- Helmestine, a. Endotermisten ja eksotermisten reaktioiden ymmärtäminen. Toipunut: Admingco.com

