Vähennys (kemia)
- 2474
- 479
- Alonzo Kirlin
 Hopeapuiden vähentäminen. Lähde: Gabriel Bolívar
Hopeapuiden vähentäminen. Lähde: Gabriel Bolívar Mikä on vähennys?
Se vähennys Se on kaikki se kemiallinen reaktio, jossa yhden reagenssin atomit lopulta saavat elektroneja, jotka voidaan nähdä myös tällä tavalla: sen avoimuus tai elektroninen ”epämukavuus” vähenee. Atomi saa elektroneja, kun laji lahjoittaa ne, ts.
Tämän tyyppistä reaktiota ei voida antaa itsessään: Jos laji hyväksyy elektronit, toisen on välttämättä annettava heille. Muuten ainetta luodaan tyhjästä, vähentäen atomeja tyhjien elektronien saatuaan. Siksi se on redox -puoliksi valon (pelkistys/hapettuminen).
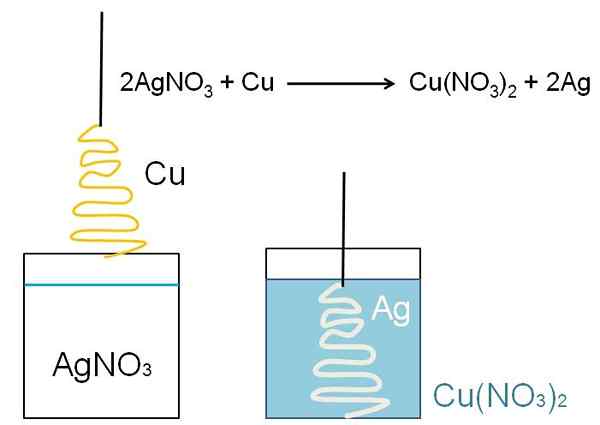
Havainnollistava esimerkki vähennyksestä, joka voidaan näyttää luokkahuoneissa, on reaktio metallin kuparin pinnan välillä ja vesipitoisen hopea -nitraattiliuos, Agno3.
Liuoksessa hopea on kationien ag+, positiivisesti ladattu. Nämä ovat vuorovaikutuksessa kuparin pinnan kanssa joulukuusen muodossa elektronit otetaan kupariatomeista. Kun näin tapahtuu, kupari korvaa hopean nitraattisuolassa, ja seurauksena kuparinitraatti muodostuu, ei3-A2.
Kotikations2+ Ei3- Ne sinisevät liuosta, ja hopea ilmentää joulukuusi ikään kuin peittäisi sen lumella.
Mikä on vähennys?
Vähennyksessä on jo sanottu, että laji saa elektroneja. Kuinka tämä voidaan tarkistaa kemiallisessa yhtälössä? Esimerkiksi Cu: n ja Agnon välisessä reaktioyhtälössä3, Kuinka tietää, milloin alennus tapahtuu? Sen varmistamiseksi on tarpeen määrittää luku- tai hapetustila.
Voi palvella sinua: elektronegatiivisuusElementeillä on luonnonvaltioissaan määritelmänä hapettumistila, joka on yhtä suuri kuin nolla, koska oletetaan, että he eivät ole menettäneet tai voittaneet elektroneja. Siten kiinteiden metallien hapettumistila ei siis ole nolla. Siten hopea kulkee +1: stä (AG+) A 0 (AG). Metalli -ionin kuorma on yhtä suuri kuin sen hapetustila.
Toisaalta elektronit tulivat kuparista: siirtyminen 0: sta (Cu) - +2 (Cu2+-A. Nitraatti -anioni, ei3- pysyy muuttumattomana, kun taas molemmat metallit vaihtavat elektroneja. Siksi yhtälö voidaan kirjoittaa seuraavasti:
2Ag+ + Cu => 2Ag + Cu2+
Huomaa, että sekä kuormat että atomit ovat tasapainossa.
Tämä koostuu kemiallisesta pelkistyksestä: Atomien hapetustilat, jotka elektronit ansaitsevat vähemmän positiivisia.
Hapen lukumäärä
Happi ovat erittäin elektronegatiivisia ja hapettavia atomeja, joten kun niiden kanssa koostuu (kuten oksidit), niillä on positiivinen hapettumismuoto, kun atomimuoto. Mitä suurempi hapen lukumäärä on vuorovaikutuksessa atomin kanssa, sitä positiivisempi sen hapetus on. Tai mikä on sama, se on hapettuneempi.
Siksi, kun yhdisteellä on vähemmän happiatomeja, sanotaan, että se on vähemmän hapettunut. Eli atomi menettää vähemmän elektroneja.
Klassinen esimerkki voidaan nähdä monoksidissa ja hiilidioksidissa. CO: lle hiilen hapetustila on +2, kun taas CO₂: n hapettumistila on +4.
Joten jos reaktiossa CO₂ muuttuu CO: ksi, sanotaan, että vähennys tapahtuu, koska hiili on nyt vuorovaikutuksessa hapen kanssa eikä kahdella. Vastakkaista reaktiota varten, CO -transformaatio, puhuu hiilen hapettumisesta.
Voi palvella sinua: rautakloridi (FECL2): rakenne, käyttö, ominaisuudetTämä pätee kaikkiin atomeihin, erityisesti metallien metallioksideihin. Esimerkiksi CRO2 (Cr4+) ja CRO3 (Cr6+-A.
Kemiallisissa yhtälöissä, joissa laji menettää happea, kun taas muut lajit ansaitsevat sen, sanotaan, että hapensiirto tapahtuu.
Elektronegatiivinen atomi
Se voidaan aina määrittää, onko vähennys muuttamalla hapettumistilan vähemmän positiiviseksi arvoksi. Kuten juuri selitit, nopea tapa huomata se edes laskelmia tekemättä, on havaita, onko happiatomeja vähentynyt yhdisteessä.
Sama voi tapahtua millä tahansa muulla atomilla, joka on enemmän elektronegatiivista kuin atomi, joka voittaa tai menettää elektroneja.
Esimerkiksi, jos vrt4 reagoi siten, että siitä tulee CHO4, Silloin sanotaan, että pelkistys tapahtui, koska fluori on paljon elektronegatiivisempi kuin vetyatomi. Seurauksena hiili on vähemmän hapettunut CHO: ssa4 että CF: ssä4, mikä on sama sanoen, että sitä on vähennetty.
Esimerkit
Orgaanisen kemian väheneminen
Esimerkki CF: stä4 ja ch4 heijastaa sitä, mitä orgaanisissa reaktioissa tapahtuu, missä atomin osittaisen kuormituksen vähentämistä pidetään elektronisena vahvistuksena. Tämä pätee suuresti, kun otetaan huomioon hapetettujen funktionaalisten ryhmien vähentäminen.
Harkitse esimerkiksi ryhmiä Roh, RCHO ja COOH. Ensimmäinen vastaa alkoholeja, joissa hiili on kytketty happea (C-OH); Toinen on aldehydiryhmä, jossa hiili muodostaa kaksoissidoksen happea ja on myös kytketty vetyyn (C = O-H), ja kolmas on karboksyyliryhmä.
Voi palvella sinua: Beryl -hydroksidi (BE (OH) 2)Karboksyyliryhmässä hiili muodostaa kaksoissidoksen o: n kanssa ja yksinkertaisen linkin toiseen O (Ho-C = O).
Siksi pelkistys tapahtuu, jos karboksyylihappo muuttuu alkoholiksi:
Rcoh => Roh
Metallinpoisto
Kemiallinen vähentäminen on erittäin tärkeää metallinpoistoprosesseissa niiden mineraaleista. Jotkut reaktioista ovat:
HGS + O2 => Hg + niin2
Elohopeasulfidi pelkistetään metallisiksi elohopeaksi.
Cu2S + o2 => 2cu + niin2
Kuparisulfidi metalliselle kuparille vähenee.
2zns + 3o2 => 2zno + 2SO2
ZnO + C => Zn + CO (Huomaa O: n siirto).
Sinkkisulfidi pelkistetään ensin sen monoksidiksi ja sitten metalliselle muotoonsa.
Usko2JOMPIKUMPI3 + 3co => 2fe + 3co2
Rautaoksidi pelkistetään metalliraudeksi.
Ora3 + 3H2 => W + 3H2JOMPIKUMPI
Ja volframitrioksidi pelkistetään metallisiksi volframiksi.
Harjoituksena metallin hapettumismäärä voidaan määrittää ennen vähentymistä.
Muita esimerkkejä
- Rauta -ioni (III) voidaan pelkistää rautaan (II):
- ETINO voidaan pelkistää etenoon:
- Etanal voidaan pelkistää etanoliksi
Viitteet
- Hapetuksen vähentämisreaktiot. Chem.Librettexts.org.
- Kemian vähentämisen määritelmä. Toipunut Ajatelukyvystä.com.




