Rubidio Historia, ominaisuudet, rakenne, hankkiminen, käyttö

- 3612
- 443
- Juan Breitenberg V
Hän rubidium Se on metallielementti, joka kuuluu jaksollisen taulukon ryhmään 1: alkalimetallit, joita edustaa RB -kemiallinen symboli. Hänen nimensä kuulostaa rubíltä, ja se johtuu siitä, että kun hänen päästöspektri löydettiin, hän osoitti voimakkaita punaisia ominaislinjoja.
Se on yksi reaktiivisimmista metalleista, joita on olemassa. Se on ensimmäinen alkalimetalleista, jotka ovat vähäisiä tiheitä, uppoaa veteen. Se reagoi hänen kanssaan myös räjähtävämmin verrattuna litiumiin, natriumiin ja kaliumiin. On ollut kokeita, joissa ampuulit tallennetaan (alempi kuva) putoamaan ja räjähtää kylpyammeissa.
 Ampulli grammalla rubidiumia, joka on varastoitu inertin ilmakehän alle. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]
Ampulli grammalla rubidiumia, joka on varastoitu inertin ilmakehän alle. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Rubidio erotetaan siitä, että se on metalli kalliimpaa kuin sama kulta; Ei niinkään sen pulasta, vaan sen laajasta mineralogisesta jakautumisesta maankuoressa ja vaikeuksissa, jotka syntyvät, kun se eristetään kaliumista ja lopeta yhdisteitä.
Se osoittaa selkeän taipumuksen liittyä kaliumiin mineraaleissaan, löytää epäpuhtauksien. Ei vain geokemiallisessa aineessa muodostaa duon kaliumin kanssa, vaan myös biokemian alalla.
Organismi "hämmentää" K -ioneja+ RB: n niille+; Rubidio ei kuitenkaan ole tähän mennessä olennainen osa, koska ei tiedetä, mikä rooli hänellä on aineenvaihdunnassa. Silti Rubidium -lisäravinteita on käytetty lievittämään tiettyjä sairauksia, kuten masennus ja epilepsia. Toisaalta molemmat ionit ampuvat violetin liekin kevyemmän kuumuudessa.
Korkeiden kustannustensa vuoksi sen sovellukset eivät perustu liikaa katalyyttien tai materiaalien synteesiin, vaan komponenttina eri laitteille, joilla on fyysinen teoreettinen emäs. Yksi niistä on atomikello, aurinkokennot ja magnetometrit. Siksi joskus rubidiumia pidetään aliarvioituna tai vähän tutkittuna metallia.
[TOC]
Historia
Saksalaiset kemistit Robert Bunsen ja Gustav Kirchhoff löysivät Rubidion vuonna 1861 spektroskopialla. Tätä varten he käyttivät Bunsen -kevyempää ja spektroskooppia, keksittiin kaksi vuotta ennen analyyttisten sademistekniikoiden lisäksi. Sen tutkimuskohde oli lepidoliitti mineraali, jonka osoittaa Saksin, Saksan kokoelman.
He aloittivat 150 kg lepidoliittimineraalia, jota he käsittelivät klooriplatiinihapolla, H2Ptcl6, Kaliumheksakloroplatinaatti, k saostaa2Ptcl6. Kun he tutkivat spektriään polttamalla sen Bunsen -kevyemmälle, he huomasivat, että heillä oli päästöjohtoja, jotka eivät ole samaan aikaan minkään muun elementin kanssa.
Tämän uuden elementin emissiospektrille on ominaista, että sillä on kaksi hyvin määritellystä viivaa punaisella alueella. Siksi hänet kastettiin nimellä 'rubidus', joka tarkoittaa 'tummanpunaista'. Sitten Bunsen ja Kirchhoff onnistuivat erottamaan RB: n2Ptcl6 k -2Ptcl6 fraktioidulla kiteytymisellä; Lopuksi vähentää sitä kloridisuoloosi vetyllä.
Tunnisti ja eristetty uuden Rubidio -elementin suolan, saksalaiset kemistit pitivät vain vähentääkseen sitä metallitilaansa. Tämän saavuttamiseksi he yrittivät kahdella tavalla: levitä elektrolyysi rubidiumkloridiin tai lämmitä helppoa suolaa vähentää, kuten tartrato. Siten metallinen rubidio syntyi.
Fysikaaliset ja kemialliset ominaisuudet
Ulkomuoto
Hopeaharmaa metalli. Se on niin pehmeä, että se näyttää voilta. Se on yleensä pakattu lasi -ampoulien sisälle, jossa hallitseva inertti ilmapiiri suojaa sitä reagoivalta ilman kanssa.
Atominumero (z)
37
Moolimassa
85 4678 g/mol
Sulamispiste
39 ºC
Kiehumispiste
688 ºC
Tiheys
Huoneenlämpötilassa: 1 532 g/cm3
Sulamispisteessä: 1,46 g/cm3
Rubidiumin tiheys on parempi kuin veden tiheä, joten se uppoaa reagoidessaan väkivaltaisesti sen kanssa.
Sulamislämpö
2,19 kJ/mol
Höyrystyslämpö
69 kJ/mol
Elektronegatiivisuus
0.82 Pauling -asteikolla
Elektroninen affiniteetti
46,9 kJ/mol
Ionisaatioenergiat
-Ensimmäinen: 403 kJ/mol (RB+ kaasumainen)
-Toinen: 2632,1 kJ/mol (RB2+ kaasumainen)
-Kolmas: 3859,4 kJ/mol (RB3+ kaasumainen)
Atomiradio
248 PM (empiirinen)
Lämmönjohtokyky
58,2 w/(m · k)
Sähkövastus
128 nω · m 20 ° C: ssa
Mohsin kovuus
0,3. Siksi jopa talkki on vaikeampi kuin metallinen rubidium.
Reaktiivisuus
 Rubidiumin liekin harjoitus. Kun hän reagoi, hän jättää hyvästit violetti liekkiin. Lähde: Didaktische.Medien [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Rubidiumin liekin harjoitus. Kun hän reagoi, hän jättää hyvästit violetti liekkiin. Lähde: Didaktische.Medien [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Rubidio on yksi reaktiivisimmista emäksisistä metalleista Cesion ja Francion jälkeen. Hän on tuskin altistunut ilmalle alkaa palata, ja jos hän on holf, hän ampuu valoisat kipinöt. Jos häntä lämmitetään, hän emittoi myös violetti liekin (ylivoimainen kuva), joka on positiivinen testi RB -ioneille+.
Voi palvella sinua: Ididio 192Reagoi hapen kanssa peroksidien seoksen muodostamiseksi (RB2JOMPIKUMPI2) ja superoksidit (RBO2-A. Vaikka se ei reagoi happojen ja emäksien kanssa, se rikkoo sitä vedellä, tuottaen rubidium- ja vetykaasuhydroksidia:
Rb (s) + h2Tai (l) => rboh (ac) + h2(g)
Reagoi vedyn kanssa vastaavan hydridin muodostamiseksi:
Rb (s) + h2(g) => 2RBH (s)
Ja myös halogeenien ja rikki räjähtävästi:
2RB (S) + CL2(g) => rbcl (s)
2RB (s) + s (l) => RB2HH)
Vaikka Rubidiumia ei pidetä myrkyllisenä elementtinä, se on potentiaalisesti vaarallinen ja edustaa paloriskejä, kun se joutuu kosketuksiin veden ja hapen kanssa.
Elektroninen rakenne ja kokoonpano
Rubidio -atomit on järjestetty siten, että ne muodostavat kehon keskittyneen kuutiometrin rakenteen (BCC). Tämä rakenne on ominaista emäksisille metalleille, jotka ovat kevyitä ja joka on taipumus kellua veden yli; Lukuun ottamatta rubidiumia (Cesio ja Francio).
Rubidio BCC -kiteissä niiden RB -atomit ovat vuorovaikutuksessa keskenään metallisen linkin ansiosta. Tätä säätelee sen valenssikerroksen "elektronien meri" 5S -kiertoradan mukaan sen elektronisen kokoonpanon mukaan:
[KR] 5s1
Kaikki 5: n kiertorataa, jolla on ainoat elektronit. Nämä vuorovaikutukset ovat kuitenkin heikkoja, koska koska alkalisten metallien ryhmä on laskeutumassa, orbitaalit muuttuvat diffuusioiksi ja siksi metallinen linkki heikentää.
Siksi rubidiumin sulamispiste on 39 ºC. Lisäksi sen heikko metallisidos selittää kiinteän kiinteän pehmeyden; niin pehmeä, että se näyttää olevan hopeavoi.
Niiden kiteiden käyttäytymisestä suurilla paineilla ei ole tarpeeksi bibliografista tietoa; Jos on tiheimpiä vaiheita, joilla on ainutlaatuisia ominaisuuksia, kuten natriumissa.
Hapetusluvut
Sen elektroninen kokoonpano osoittaa kerran, että Rubidium pyrkii vahvasti menettää ainoan elektroninsa tulemaan isolektroniseksi jalokaasulle Kripton Gas. Kun se tapahtuu+. Sanotaan.
Koska rubidium hapettaa, oletus, että RB -ioneja on olemassa+ Yhdisteissä se on onnistunut, mikä puolestaan osoittaa näiden yhdisteiden ionisen luonteen.
Lähes kaikissa Rubidium -yhdisteissä tämä osoittaa hapettumismäärä +1. Esimerkkejä heistä ovat seuraavat:
-Rubid -kloridi, RBCL (RB+Cl--A
-Rubidio -hydroksidi, RBOH (RB+ vai niin--A
-Rubidio karbonaatti, RB2Yhteistyö3 (RB2+Yhteistyö32--A
-Rubidio -monoksidi, RB2Tai (RB2+JOMPIKUMPI2--A
-Rubidium -superoksidi, RBO2 (RB+JOMPIKUMPI2--A
Vaikka se olisi hyvin harvinaista, rubidiumilla voi olla myös negatiivinen hapettumisnumero: -1 (RB--A. Tässä tapauksessa puhumme "rubidiuro", jos hän muodostaa yhdisteen, jolla on vähemmän sähkövaiheinen elementti kuin hän, tai jos hän toimittaa erityisissä ja tiukissa olosuhteissa.
Klusterit
On yhdisteitä, joissa jokaisella RB -atomilla on hapettumisluvut, joilla on fraktioarvot. Esimerkiksi RB: ssä6Tai (RB62+JOMPIKUMPI2-) ja RB9JOMPIKUMPI2 (RB94+JOMPIKUMPI22-) Positiivinen kuorma jakautuu RB -atomien joukkoon (klusterit). Siten RB: ssä6Tai teoriassa hapettumisnumero olisi +1/3; RB: ssä9JOMPIKUMPI2, + 0,444 (4/9).
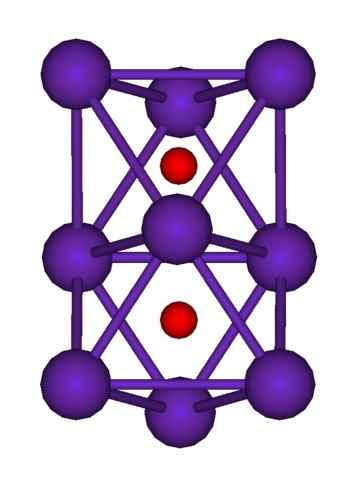 RB9O2 -klusterirakenne. Lähde: Axiosaurus [julkinen alue]
RB9O2 -klusterirakenne. Lähde: Axiosaurus [julkinen alue] RB -klusterirakenne on esitetty yllä9JOMPIKUMPI2 edustaa palloja ja baarimallia. Huomaa, kuinka yhdeksän RB -atomia "sulkee" anionit tai2-.
Elekubraation avulla se on kuin osa rubidiumin alkuperäisiä metallikiteitä pysyi muuttumattomina erottaessaan äidikiteestä. He menettävät elektronit prosessissa; ne, jotka ovat välttämättömiä houkuttelemaan tai2-, ja tuloksena oleva positiivinen varaus jakautuu kaikkien mainitun klusterin atomien kesken (RB -atomien asetukset tai aggregaatit).
Siten näissä rubidiumklustereissa RB: n olemassaoloa ei voida muodollisesti olettaa+. RB6Tai RB9JOMPIKUMPI2 Ne luokitellaan Rubidium -suboksideiksi, joissa tämä näennäinen poikkeavuus toteutetaan, että sillä on ylimääräinen metalliatomeja suhteessa oksidianioneihin.
Missä se on ja saa
maapallon kuori
 Lepidoliitti mineraalinäyte. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Lepidoliitti mineraalinäyte. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Rubidio on maankuoren runsain elementti 23, ja runsaus on verrattavissa sinkin, lyijyn, cesium- ja kuparimetallien kanssa. Yksityiskohta on, että heidän ionit levitetään laajasti, joten se ei ole hallitseva missään mineraalissa päämetalliselostena, ja niiden malmit ovat myös vähän.
Voi palvella sinua: Grignard Reagenssi: valmistelu, sovellukset, esimerkitJuuri tästä syystä Rubidio on erittäin kallis metalli, jopa enemmän kuin sama kulta, koska sen Menas -prosessi on monimutkainen sen hyväksikäytön vaikeuden vuoksi.
Luonnossa, kun otetaan huomioon sen reaktiivisuus, Rubidium ei ole alkuperäisessä tilassa, vaan oksidina (RB2O), kloridi (RBCL) tai muihin anioneihin. Sen "ilmaiset" RB -ionit+ Ne ovat merissä, joiden konsentraatio on 125 µg/l, samoin kuin kuumissa lähteissä ja jokissa.
Maapallon kuoren mineraalien joukossa, joka sisältää sen alle 1%: n pitoisuutena: meillä on:
-Leucita, k [alsi2JOMPIKUMPI6-
-Polucita, CS (kyllä2Hei6· NH2JOMPIKUMPI
-Carnalita, KMGCL3· 6H2JOMPIKUMPI
-Zinnwaldita, Klifeal (Alsi3)JOMPIKUMPI10(Voi f)2
-Amazonita, PB, Kalsi3JOMPIKUMPI8
-Petalita, liasi4JOMPIKUMPI10
-Biotita, K (mg, usko)3Alsi3JOMPIKUMPI10(Voi f)2
-Rubiclina, (rb, k) alsi3JOMPIKUMPI8
-Lepidolita, K (Li, Al)3(Kyllä, Al)4JOMPIKUMPI10(F, OH)2
Geokemiallinen yhdistys
Kaikilla näillä mineraaleilla on yksi tai kaksi yhteistä asiaa: ne ovat kalium-, cesium- tai litium -silikaatteja tai ovat näiden metallien mineraalisuoloja.
Tämä tarkoittaa, että Rubidiolla on vahva taipumus liittyä kaliumiin ja cesioon; Se voi jopa korvata kaliumin mineraalien tai kivien kiteytymisen aikana, kuten se tapahtuu pegmatitasin pelloilla, kun magma kiteytyy. Siten Rubidio on sivutuote näiden kivien ja niiden mineraalien hyväksikäytöstä ja puhdistamisesta.
Rubidio voi olla myös yhteisiä kiviä, kuten graniitti, savet ja basaltti ja jopa hiilipitoiset kerrostumat. Kaikista luonnollisista lähteistä lepidoliitti edustaa päämalmiaan ja josta sitä käytetään kaupallisesti.
Karnaliitissa toisaalta Rubidio löytyy RBCL -epäpuhtauksista, joiden pitoisuus on 0,035%. Ja suuremmassa konsentraatiossa on polucitasin ja rubiclinien kerrostumat, joilla voi olla jopa 17% Rubidiumista.
Sen geokemiallinen yhteys kaliumiin johtuu sen ionisten radioiden samankaltaisuudesta; RB+ on suurempi kuin k+, Mutta kokokokoerot eivät ole este ensimmäiselle, joka korvaa toisen mineraalikiteissä.
Murto-
Perustuuko se lepidoliittiin tai polucitaan tai mihin tahansa edellä mainituihin mineraaleihin, haaste pysyy samana suurempaan tai pienempaan asteeseen: rubidiumin erottaminen kaliumista ja cessiumista; Eli levitä seoksen erotustekniikoita, jotka sallivat toisaalta Rubidium -yhdisteet tai suolat ja toisaalta kaliumin ja cesiumin.
Tämä on vaikeaa, koska nämä ionit (k+, RB+ ja CS+) jaa suuri kemiallinen samankaltaisuus; Ne reagoivat samalla tavalla muodostaen samat suolat, jotka tuskin eroavat toisistaan niiden tiheyksien ja liukoisuuden ansiosta. Siksi fraktioitua kiteyttämistä käytetään, jotta ne voivat hitaasti ja hallita.
Tätä tekniikkaa käytetään esimerkiksi karbonaattien ja alunien seoksen erottamiseen näistä metalleista. Uudelleenkiteyttämisprosessit olisi toistettava useita kertoja, jotta voidaan taata koostetut ionien lopulliset ja vapaat kiteet; Rubidium -suola, joka kiteytyy k -ioneilla+ tai CS+ sen pinnalla tai sisällä.
Nykyaikaisemmat tekniikat, kuten ioninvaihtohartsin käyttö tai kruunut monimutkaisina aineina, sallivat myös RB -ionit+.
Elektrolyysi tai alennus
Kun rubid -suola on ollut mahdollista erottaa ja puhdistaa, seuraava ja viimeinen vaihe on vähentää kationien RB+ kiinteälle metallille. Tätä varten suola sulaa ja altistetaan elektrolyysille rubidiumin saostamiseksi katodissa; tai käytetään voimakasta pelkistävää aineita, kuten kalsiumia ja natriumia, pystyy menettämään elektronit nopeasti ja vähentävät siten Rubidiumia.
Isotoopit
Rubidio löytyy maapallolta kahtena luonnollisena isotooppina: 85RB ja 87RB. Ensimmäisen runsaasti on 72,17%, kun taas toinen 27,83%.
Hän 87RB on vastuussa siitä, että tämä metalli on radioaktiivinen; Sen säteily on kuitenkin vaarattomia ja jopa hyödyllisiä treffanalyysille. Puoli -elämä (t1/2) on 4,9 · 1010 vuosia, joiden ajanjakso ylittää maailmankaikkeuden iän. Kun se hajoaa, siitä tulee vakaa isotooppi 87Herra.
Tämän ansiosta tätä isotooppia on käytetty tähän mennessä mineraalien ja maankivien ikää, joita on läsnä maan alusta lähtien.
Isotooppien lisäksi 85RB ja 87RB, on muita synteettisiä ja radioaktiivisia vaihtelevilla ja paljon lyhyemmillä elämäajalla; Esimerkiksi hän 82RB (t1/2= 76 sekuntia), 83RB (t1/2= 86,2 päivää), 84RB (t1/2= 32,9 päivää) ja 86RB (t1/2= 18,7 päivää). Kaikista niistä, 82RB on eniten käytetty lääketieteellisissä tutkimuksissa.
Riskejä
Metalli
Rubidio on niin reaktiivinen metalli, että se on säilytettävä lasivampuleissa inertin ilmakehän alla, jotta se ei reagoi ilman hapen kanssa. Jos mainitut ampulliruutaat, metalli voidaan sijoittaa petroliin tai mineraaliöljyyn sen suojaamiseksi; Se lopulta hapettaa liuenneen hapen hapettimeen, mikä johtaa Rubidium -peroksideihin.
Se voi palvella sinua: natriumsyanidi (NACN): rakenne, ominaisuudet, riskit, käyttötarkoituksetJos päinvastoin päätettiin sijoittaa se esimerkiksi puuhun, se lopulta palaa violetti liekillä. Jos kosteutta on paljon, se palaa pelkkä tosiasia altistumisesta ilmalle. Kun suurta rubidiumia vältetään veden tilavuudella, se hyödyntää voimakkaasti, saavuttaen vedyn tuotetun kaasun tulessa.
Siksi Rubidium on metalli, jonka pitäisi manipuloida, koska kaikki sen reaktiot ovat käytännössä räjähtäviä.
Ionit
Toisin kuin metallinen rubidium, sen RB -ionit+ Ne eivät edusta mitään ilmeistä riskiä eläville olentoille. Nämä veteen liuenneet ovat vuorovaikutuksessa solujen kanssa samalla tavalla kuin k -ionit+.
Siksi rubidiumilla ja kaliumilla on samanlainen biokemiallinen käyttäytyminen; Rubidium ei kuitenkaan ole välttämätön elementti, kun taas kalium kyllä. Tällä tavoin huomattavia määriä RB: tä+ Ne voivat kertyä solujen sisätiloihin, punasoluihin ja sisäelimiin vaikuttamatta negatiivisesti minkä tahansa eläimen runkoon.
Itse asiassa on arvioitu, että aikuinen mies, jonka massa on 80 kg, sisältää noin 37 mg Rubidioa; Ja että tämän pitoisuuden lisääntyminen luokkaa 50 - 100 kertaa ei johda ei -toivottuihin oireisiin.
Kuitenkin ylimääräiset RB -ionit+ voi lopulta siirtyä k -ioneihin+; Ja näin ollen henkilö kärsii erittäin vahvoista lihasten kouristuksista kuolemaan asti.
Loogisesti, Salvor -suolat tai Rubidium -yhdisteet voivat laukaista tämän heti, joten yhtäkään niistä ei tule nautittaa. Lisäksi se voi aiheuttaa yksinkertaisia kontaktipolttoa ja myrkyllisimpiä fluoria (RBF), Rubidiumin hydroksidia (RBOH) ja syanidia (RBCN).
Sovellukset
Kaasunkeräin
Rubidioa on käytetty kaappaamaan tai poistamaan kaasujen jäljet, joita voi olla tyhjiö suljetuissa putkissa. Juuri koska heillä on suuri taipumus vangita happea ja kosteutta, he eliminoivat ne pinnallaan peroksideina.
Pyrotekniikka
Kun rubidio-suolat polttavat ominaisen violetti-punaisen liekin. Joidenkin ilotulitteiden koostumuksessaan on nämä suolat niin, että ne räjähtävät näillä väreillä.
Täydentää
Rubidio -kloridia on määrätty masennuksen torjumiseksi, koska tutkimukset määrittivät tämän elementin alijäämän tästä sairaudesta kärsiville henkilöille. Sitä on käytetty myös sedatiivisena ja epilepsian hoitoon.
Bose-Einstein-kondensaatti
Isotooppiatomit 87RB: tä käytettiin ensimmäisen Bose-Einstein-kondensaatin luomiseen. Tämä ainetila on, että atomit lämpötilassa melko lähellä absoluuttista nollaa (0 K), ryhmitelty tai "kondensan", käyttäytyen ikään kuin ne olisivat sellaisia.
Siten Rubidio oli tämän voiton päähenkilö fysiikan kentällä, ja Eric Cornell, Carl Wieman ja Wolfgang Ketterle saivat Nobel -palkinnon vuonna 2001 tämän työn ansiosta tämän työn ansiosta.
Tuumoridiagnoosi
Synteettinen radioisotooppi 82RB hajoaa säteilemällä positroneja, joita käytetään kerääntymiseen kaliumrikkaisiin kudoksiin; Kuten aivoissa tai sydämessä. Siksi sitä käytetään sydämen toiminnallisuuden ja aivojen mahdollisten kasvainten läsnäolon analysointiin positroniemissiotomografian kautta.
Komponentti
Rubidio -ionit ovat löytäneet tilaa erityyppisissä materiaaleissa tai seoksissa. Esimerkiksi heidän seokset, joissa on kultaa, cesiumia, elohopeaa, natriumia ja kaliumia, on valmistettu. Se on lisätty lasiin ja keramiikkaan todennäköisesti niiden sulamispisteen lisäämiseksi.
Perovskitas -aurinkokennoissa ne on lisätty tärkeänä komponenttina. Samoin sen mahdollista käyttöä on tutkittu termoelektrisenä generaattorina, lämmönvaihtomateriaalina avaruudessa, polttoainetta ionisten työntömoottorien, elektrolyyttisen väliaineen alkalisissa paristoissa ja atomi -magnetometreissä.
Atomi -kellot
Rubidiumilla ja lakkaa, kuuluisat atomikellot on valmistettu, erittäin tarkka, ja niitä käytetään esimerkiksi GPS -satelliitteissa, joiden kanssa älypuhelimiensa omistajat voivat tietää heidän sijaintinsa tien päällä liikkuessa.
Viitteet
- Sidosmi. (29. lokakuuta 2008). Rubidium. Toipunut: ChemistryWorld.com
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Rubidium. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2019). Rubidium. Pubchem -tietokanta. CID = 5357696. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Chellan, P., & Sadler, P. J -. (2015). Elämän ja lääkkeiden elementit. Filosofiset tapahtumat. Sarjan A, matemaattiset, fyysiset ja tekniikan tieteet, 373 (2037), 20140182. Doi: 10.1098/rsta.2014.0182
- Toukokuu lääketieteellisen koulutuksen ja tutkimuksen säätiö. (2019). Rubidium RB 82 (laskimonsisäinen reitti). Palautettu: Mayokliininen.org
- Marques Miguel. (S.F.-A. Rubidium. Toipunut: Nautilus.Fis.UC.Pt
- James L. Väriaine. (12. huhtikuuta 2019). Rubidium. Encyclopædia britannica. Toipunut: Britannica.com
- DR. Doug Stewart. (2019). Rubidium -elementti tosiasiat. Kemikooli. Toipunut: Chemicool.com
- Michael Pilgaard. (10. toukokuuta 2017). Rubidium kemialliset reaktiot. Toipunut: Pilgaardelegs.com

