Diatsoniumsuolat

- 4617
- 1052
- Ronald Reilly
Selitämme, mitkä diatsoniumsuolat ovat, kuinka niiden ominaisuudet ja sovellukset muodostuvat
Mitä ovat diatsoniumsuolat?
Se Diatsoniumsuolat Ne ovat orgaanisia yhdisteitä, joissa ionisia vuorovaikutuksia AZO-ryhmän välillä (-n2+) Ja anioni x- (Cl-, F-, CH3Kujertaa-, jne.-A. Sen yleinen kemiallinen kaava on RN2+X-, ja tässä sivuketju R voi olla hyvin alifaattinen ryhmä tai aryyliryhmä; eli aromaattinen rengas.
Alemmassa kuvassa arenodiatsoniumionien rakenne on edustettuna. Siniset pallot vastaavat AZO -ryhmää, kun taas mustavalkoinen muodostavat fenyyliryhmän aromaattisen renkaan. AZ+≡N).

On kuitenkin resonanssirakenteita, jotka poistavat tämän positiivisen kuorman, esimerkiksi naapurimaiden typen atomiin: -n = n+. Tämä on peräisin, kun pari elektronia, jotka muodostavat linkin, on suunnattu vasemmalla olevaan typpiatomiin.
Samoin tämä positiivinen kuorma pystyy purkamaan aromaattisen renkaan PI -järjestelmän läpi. Seurauksena on, että aromaattiset diatsoniumsuolat ovat stabiilia kuin alifaattiset, koska positiivinen kuorma ei voi purkaa hiiliketjua pitkin (CH3, CH2CH3, jne.-A.
Koulutus
Nämä suolat johtuvat primaarisen aminan reaktiosta natriumnitriitin happoseoksella (nano2-A.
Toissijainen amiinit (R2Nh) ja tertiäärinen (r3N) Muut typpituotteet, kuten N-nitrosoamiini (jotka ovat kellertäviä öljyjä), amiinisuoloja (R3H N+X-) ja N-nitrosoniumyhdisteet.
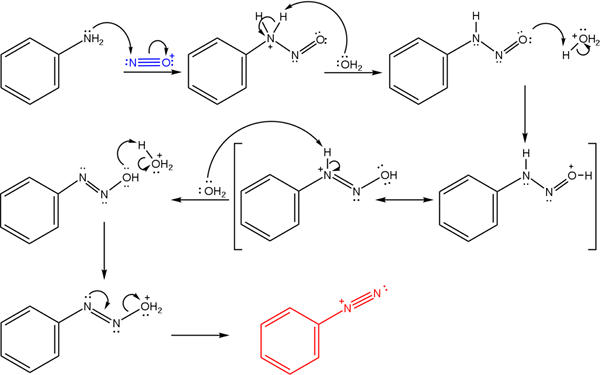
Ylivoimainen kuva kuvaa mekanismia, jolla diatsoniumsuolojen muodostuminen tai joka tunnetaan myös nimellä diatsotisointireaktio.
Voi palvella sinua: Chrome (CR)Reaktio alkaa fenyyliamiinista (AR-NH2), joka suorittaa nukleofiilisen hyökkäyksen nitrosoniumkationiatomiin (ei+-A. Tätä kationia tuottaa nanoseos2/Hx, missä x on yleensä Cl; eli HCL.
Nitrosoniumkationin muodostuminen vapauttaa vettä keskellä, joka nappaa positiivisesti ladatun typen protonin.
Sitten tämä sama vesimolekyyli (tai muut happolajit, jotka eroavat h3JOMPIKUMPI+) tuota protonin happea, demokraation positiivisen kuorman demokronointi vähemmän elektronegatiivisessa typpiatomisessa).
Nyt vesi on jälleen suojaamaton typelle ja tuottaa sitten diatsohydroksidimolekyylin (sekvenssin antipenultimimate).
Koska väliaine on hapan, diatsohydroksidi kärsii OH -ryhmän kuivumisesta; Elektronisen avoimen työpaikan torjumiseksi AZO -ryhmän kolminkertaisen linkin vapaa vääntömomentti.
Tällä tavoin mekanismin lopussa Bencenodiatsoniumkloridi pysyy liuoksessa (C6H5N2+Cl--A.
Ominaisuudet
Yleensä diatsoniumsuolat ovat värittömiä ja kiteisiä, liukoisia ja stabiileja alhaisissa lämpötiloissa (alle 5 ° C).
Jotkut näistä suoloista ovat niin herkkiä mekaanisille vaikutuksille, että mikä tahansa fyysinen manipulointi voisi räjäyttää ne. Lopuksi he reagoivat veden kanssa fenolien muodostamiseksi.
Siirtymäreaktiot
Diatsoniumsuolat ovat potentiaalisia molekyylityppi, jonka muodostuminen on siirtymäreaktioiden yleinen nimittäjä. Näissä laji X syrjäyttää epävakaan AZO -ryhmän, pakeneen n2(g).
Sandmeyer -reaktio
RNA2+ + Cucl => arcl + n2 + Cu+
RNA2+ + Cucn => arcn + n2 + Cu+
Gatterman -reaktio
RNA2+ + Cox => arx + n2 + Cu+
Toisin kuin Sandmeyerin reaktio, Gattermanin reaktiolla on metalli kupari hänen halogenidin sijasta; eli kux syntyy In situ.
Schiemann -reaktio
[RNA2+] BF4- => Arf + bf3 + N2
Voi palvella sinua: Ketonit: Tyypit, ominaisuudet, nimikkeistö, käyttötarkoitukset, esimerkitSchiemannin reaktiolle on ominaista Benzezonium -fluoroboraation lämpöhajoaminen.
Gomberg Bachmann -reaktio
[RNA2+] Cl- + C6H6 => Ar - c6H5 + N2 + HCL
Muut siirtymät
RNA2+ + Ki => ari + k+ + N2
[RNA2+] Cl- + H3Poikki2 + H2O => c6H6 + N2 + H3Poikki3 + HCL
RNA2+ + H2O => aroh + n2 + H+
RNA2+ + Leima2 => Arno2 + N2 + Cu+
Redox -reaktiot
Diatsoniumsuolat voidaan pelkistää arilhydratsiineiksi käyttämällä CNCL: n seosta2/HCL:
RNA2+ => Arnhnh2
Ne voidaan myös pelkistää arilamiineiksi voimakkaammissa pelkistyksissä Zn/HCl: n kanssa:
RNA2+ => Rnah2 + Nh4Cl
Fotokemiallinen hajoaminen
[RNA2+] X- => Arx + n2
Diatsoniumsuolat ovat herkkiä hajoamiseen ultraviolettisäteilyn esiintymisellä tai hyvin läheisillä aallonpituuksilla.
Azo -kytkentäreaktiot
RNA2+ + Ar'h → RNA2Ar ' + h+
Nämä reaktiot ovat ehkä diatsoniumsuolojen hyödyllisimmät ja monipuolisimmat. Nämä suolat ovat heikkoja elektrofiilejä (rengas muuttaa AZO -ryhmän positiivisen kuorman). Aromaattisten yhdisteiden kanssa reagoimiseksi ne on ladattava negatiivisesti, mikä aiheuttaa AZOS -yhdisteitä.
Reaktio kulkee tehokkaan suorituskyvyn pH: n välillä 5 - 7. Happamassa pH.
Myös emäksisessä pH: ssa (yli 10) diatsoniumsuolaa reagoi OH: n kanssa- Tuottaa diatsohydroksidia, joka on suhteellisen inertti.
Tämän tyyppisten orgaanisten yhdisteiden rakenteilla on erittäin stabiili konjugoitu PI -järjestelmä, jonka elektronit absorboivat ja pääsevät säteilyyn näkyvässä spektrissä.
Näin ollen atsoyhdisteille on ominaista värikkäitä. Tämän ominaisuuden takia niitä on kutsuttu myös atsoic -väreiksi.
Voi palvella sinua: molaarisuus: pitoisuus, yksiköt, laskenta, harjoitukset
Ylivoimainen kuva kuvaa esimerkkinä kytkemisen käsitettä metyylin oranssin kanssa. Rakenteensa keskellä AZO -ryhmää voidaan havaita kahden aromaattisen renkaan liittimenä.
Mikä kahdesta renkaasta oli elektrofia kytkennän alussa? Oikealla puolella, koska sulfonaattiryhmä (-so3) Poista elektroninen rengastiheys, mikä tekee siitä vielä enemmän elektrofiiliä.
Sovellukset

Yksi sen kaupallisimmista sovelluksista on väriaineiden ja pigmenttien tuotanto, joka kattaa myös tekstiiliteollisuuden kankaan kulutuspinnassa. Nämä atsoiset yhdisteet on ankkuroitu polymeerin spesifisiin molekyylipaikkoihin, värejen kuolemaan.
Fotoliittisen hajoamisensa vuoksi se on (vähemmän kuin ennen) käytettynä asiakirjojen jäljennöksessä. Kuten? Erityisen muovin peittämät paperialueet poistetaan ja sitten levitetään perusfenoliliuos, värittää kirjaimet tai muotoilu sininen.
Orgaanisessa synteesissä niitä käytetään lähtökohtina monille aromaattisille johdannaisille.
Lopuksi, heillä on sovelluksia älykkäiden materiaalien alalla. Näissä pinta (esimerkiksi kultaa) on kytketty, jolloin se antaa kemiallisen vasteen ulkoisille fysikaalisille ärsykkeille.

