Seleenihistoria, ominaisuudet, rakenne, hankkiminen, käyttö

- 4237
- 1204
- Dr. Travis Reichert
Hän seleeni Se on ei -metallinen kemikaali, joka kuuluu jaksollisen taulukon ryhmälle 16 ja jota symboli on. Tällä elementillä on välilaite rikin ja Telurion välillä, jotka ovat saman ryhmän jäseniä.
Jöhs J löysi seleenin vuonna 1817. Berzelius ja John G. Pyriitin höyrystynyt Gahn havaitsi punaisen jäännöksen (alempi kuva). Aluksi he sekoittivat hänet telurioon, mutta huomasivat sitten, että he olivat edessään uutta elementtiä.
 Pullo, jossa on amorfinen punainen seleeni, tunnetuin alotrooppinen tälle elementille. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Pullo, jossa on amorfinen punainen seleeni, tunnetuin alotrooppinen tälle elementille. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Berzelius kutsui uutta elementtiä seleeniksi, joka perustuu "Selene" -nimeen, joka tarkoittaa "Moon Goddess". Seleeni on välttämätön jälki kasveille ja eläimille, vaikka korkeissa pitoisuuksissa se on myrkyllinen elementti.
Seleenillä on kolme pääajoja -muotoa: punainen, musta ja harmaa. Jälkimmäisellä on ominaisuus modifioida sen sähkönjohtavuutta sen säteilevän valon voimakkuuden perusteella (valojohtaja), joten sillä on ollut monia sovelluksia.
Seleeni on levinnyt laajasti maankuoressa, mutta sitä sisältävät mineraalit eivät ole runsaasti, joten seleenin kaivostoiminnan hyödyntämistä ei ole käytetty.
Se saadaan pääasiassa jalostusprosessin toissijaisena tuotteena kuparin elektrolyysillä. Seleeni kertyy limaan, joka on elektrolyysisolujen anodissa.
Ihmisillä on noin 25 seleenoproteiinia, joista osa toteutetaan antioksidanttivaikutuksen ja hallitsevat vapaiden radikaalien muodostumista. Siellä on myös seleenin aminohapoja, kuten selenomectionine ja selenokysteiini.
[TOC]
Historia
Ensimmäinen havainto
Villanovan alkemisti Arnold on saattanut seurata seleeniä vuonna 1230. Tämä muodostettiin lääketieteessä Pariisin Sorbonnessa, ja se oli jopa paavi Clemente V: n tohtori.
Villanova kirjassaan Rosariumfilosoforum Kuvaile punaista rikkiä tai "rikki rebouliaa", joka oli pysynyt uunissa rikin höyrystymisen jälkeen. Tämä punainen rikki olisi voinut olla seleenin alotrooppinen.
Löytö
Vuonna 1817 Jöhs Jakob Berzelius ja John Gottlieb Gahn löysivät seleenin kemiallisesta kasvista rikkihapon tuotantoa varten, lähellä Gripsholmia, Ruotsi. Raaka -aine hapon kehittämiseksi oli pyriitti, joka uutettiin Falun -kaivoksesta.
Berzelius iski punaisen jäännöksen olemassaolosta, joka pysyi lyijysäiliössä rikin palaneen jälkeen.
Myös Berzelius ja Gahn havaitsivat, että punaisella jäännöksellä oli voimakas mausteisen retiisin tuoksu, samanlainen kuin Telurion esittämä. Syy, miksi hän kirjoitti ystävälleen Marectille uskovansa, että havaittu talletus oli telurioyhdiste.
Beelius kuitenkin jatkoi talletetun materiaalin analysointia polttamalla pyriitti ja harkitsee uudelleen, että Telurioa ei ollut löydetty Falunista. Päättyi helmikuussa 1818, että hän oli löytänyt uuden elementin.
Nimesi alkuperä
Berzelius huomautti, että uusi elementti oli rikin ja telurion yhdistelmä ja että Telurion samankaltaisuus uuden elementin kanssa oli antanut hänelle mahdollisuuden nimetä uusi seleeni -aine.
Berzelius selitti, että "Tellus" tarkoittaa maan jumalatar. Martin Klaport vuonna 1799 asetti tämän nimen Telurioon ja kirjoitti: ”Mitään elementtiä ei kutsuta vain niin. Se oli tehtävä!".
Telurion samankaltaisuuden vuoksi uudella aineella Berzelius kutsui sitä sanalla seleeniä, joka on johdettu kreikkalaisesta sanasta "Selene", joka tarkoittaa "kuun jumalatar".
Sovellusten kehittäminen
Vuonna 1873 Willoughby Smith havaitsi, että seleenin esittämä sähkönjohtavuus riippui siitä säteilevästä valosta. Tämä ominaisuus antoi seleenille lukuisia sovelluksia.
Alexander Graham Bell vuonna 1979 käytti seleeniä fotofonissaan. Seleeni tuottaa sähkövirran, joka on verrannollinen sitä valaisevan valon voimakkuuteen, käyttämällä valonmittareita, turvamekanismeja ovien avaamiseen ja sulkemiseen jne.
Seleenin tasasuuntaajien käyttö elektroniikassa alkoi 1930 -luvulta, lukuisilla kaupallisilla sovelluksilla. 1970 -luvulla hänet korvattiin piin tasasuuntaajissa.
Vuonna 1957 havaittiin, että seleeni oli olennainen osa nisäkkäiden elämää, koska sitä oli läsnä entsyymeissä, jotka suojaavat reaktiiviselta happelta ja vapaiden radikaaleilta. Lisäksi löydettiin aminohappojen, kuten selenometioniini, olemassaolo.
Fysikaaliset ja kemialliset ominaisuudet
Ulkomuoto
Seleenille on useita alotrooppeja, niiden fyysinen ulkonäkö vaihtelee. Se esitetään yleensä punertavan kiinteänä muodossa.
Vakioatomipaino
78 971 U
Atominumero (z)
3. 4
Sulamispiste
221 ºC
Kiehumispiste
685 ºC
Tiheys
Seleenitiheys vaihtelee riippuen siitä, mitä alotrooppista tai polymorfia tarkastellaan. Jotkut sen määritettyistä tiheydestä huoneenlämpötilassa ovat:
Harmaa: 4 819 g/cm3
Alfa: 4,39 g/cm3
Lasimainen: 4,28 g/cm3
Nestemäinen tila (sulamispiste): 3,99 g/cm3
Sulamislämpö
Harmaa: 6,69 kJ/mol
Höyrystyslämpö
95,48 kJ/mol
Molaarinen kalorikapasiteetti
25 363 j/(mol · k)
Hapetusluvut
Seleeni voidaan kytkeä sen yhdisteisiin, jotka ilmenevät seuraavat numerot tai hapettumistilat: -2, -1, +1, +2, +3, +4, +5, +6. Heidän joukossaan tärkeimmät ovat -2 (2-), +4 (tiedän4+) ja +6 (tiedän6+-A.
Voi palvella sinua: yksinkertainen mikroskooppiEsimerkiksi SEO: ssa2 Seleenillä on +4 hapettumisnumero; eli kationin olemassaolo oletetaan4+ (HÄN4+JOMPIKUMPI22--A. Samanlainen kuin SEO3 Seleenillä on +6 hapettumisnumero (i6+JOMPIKUMPI32--A.
Vety seleniuro, h2SE, seleenin hapettumismäärä on -2; eli jälleen oletetaan ionin tai anionin olemassaolon2- (H2+HÄN2--A. Tämä johtuu siitä, että seleeni on enemmän elektronegatiivista kuin vety.
Elektronegatiivisuus
2.55 Pauling -asteikolla.
Ionisaatioenergia
-Ensimmäinen: 941 kJ/mol.
-Toiseksi: 2.045 kJ/mol.
-Kolmas: 2.973,7 kJ/mol.
Magneettinen järjestys
Diagneettinen.
Kovuus
2.0 MOHS -asteikolla.
Isotoopit
Seleeniä on viisi luonnollista ja vakaa isotooppia, jotka on esitetty alla olevilla määrillä:
-74SE (0,86%)
-76SE (9,23%)
-77SE (7,6%)
-78SE (23,69%)
-80SE (49,8%)
Allotropia
 Musta pullo, joka on päällystetty ohuella kalvolla seleeniharmaa. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Musta pullo, joka on päällystetty ohuella kalvolla seleeniharmaa. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Kemiallisissa reaktioissa valmistettu seleeni on tiili punainen amorfinen jauhe, joka perustuu lasimainen musta muoto, samanlainen kuin Rosario -tilit (ylivoimainen kuva). Musta seleeni on hauras ja kiiltävä kiinteä.
Lisäksi musta seleeni liukenee hiukan hiilisulfidiin. Kun tätä liuosta lämmitetään 180 ºC: n lämpötilassa, harmaa seleeni saostuu, sen stabiilin ja tihein alotrooppinen.
Harmaa seleeni on resistentti hapettumiselle ja on inertti ei -hapimattomien happojen vaikutuksesta. Tämän seleenin pääominaisuus on sen valojohde. Valaistuminen lisää sen sähkönjohtavuutta kertoimella 10-15 kertaa.
Reaktiivisuus
Sen yhdisteiden seleeni on hapetustilassa -2, +4 ja +6. Ilmenee selkeän taipumuksen muodostaa happoja korkeammissa hapetustilassa. Yhdisteitä, joilla on seleeniä hapetustilassa -2, kutsutaan Seleniurosiksi (2--A.
Vetyreaktio
Seleeni reagoi vedyn kanssa vedyn seleniuron muodostamiseksi (H2Se), väritön, syttyvä ja haiseva kaasu.
Happireaktio
Seleeni palaa lähettämällä sininen liekki ja muodostamalla seleenidioksidi:
HÄN8 (s) + 8 o2 => 8 SEO2 (S)
Seleenioksidi on polymeeri, valkoinen ja kiinteä aine. Sen nesteytys tuottaa seleenihapoa (H2SEO3-A. Seleeni muodostaa myös seleenitrioksidin (SEO3), Analoginen rikki (niin3-A.
Reaktio halogeenien kanssa
Seleeni reagoi fluoridin kanssa seleeniheksafluoruron muodostamiseksi:
HÄN8 (s) +24 f2 (g) => 8 SEF6 (L)
Seleeni reagoi kloorin ja bromin kanssa dikloridi- ja dysileeni -dibromuren muodostamiseksi:
HÄN8 (s) +4 cl2 => 4 SE2Cl2
HÄN8 (s) +4 br2 => 4 SE2Br2
Seleeni voi myös muodostaa SEF: n4 ja Sechl4.
Toisaalta seleeni muodostaa yhdisteitä, joissa seleenin atomi liittyy yhteen halogeenin ja toisen happea. Tärkeä esimerkki on seleenioksikloridi (SEO2Cl2), Seleenin hapettumisessa +6, erittäin voimakas liuotin.
Reaktio metallien kanssa
Seleeni reagoi metallien kanssa alumiini-, kadmium- ja natrium -seleniurosten muodostamiseksi. Alla olevan kemikaali vastaa alumiinin seleniuron muodostumista:
3 se8 + 16 Al => 82HÄN3
Selenitas
Seleeni muodostaa suolat, jotka tunnetaan nimellä Selenitas; Esimerkiksi: Hopea seleniitti (AG2SEO3) ja natrium seleniitti (NA2SEO3-A. Tätä nimeä on käytetty kirjallisessa yhteydessä viittaamaan kuun asukkaisiin: Selenitas.
Hapot
Tärkein seleenihappo on tiivistihappo (H2SEO4-A. Se on yhtä vahva kuin rikkihappo ja vähenee helpommin.
Elektroninen rakenne ja kokoonpano
- Seleeni ja sen linkit
Seleenissä on kuusi Valencia -elektronia, minkä vuoksi se sijaitsee ryhmässä 16, sama kuin happi ja rikki. Nämä kuusi elektronia löytyy 4S- ja 4p -kiertoradalla niiden elektronisen kokoonpanon mukaan:
[AR] 3D10 4S2 4P4
Siksi, kuten rikki, muodostavat kaksi kovalenttisia sidoksia Valencian oktettinsa suorittamiseksi; Vaikka sen 4D -orbitaalit ovat saatavana linkittääkseen enemmän kuin kaksi atomia. Siten kolme seleeniatomia lähestyy ja muodostavat kaksi kovalenttisia sidoksia: se-se-se.
Seleenillä, jolla on suurempi atomimassa, on luonnollinen taipumus muodostaa rakenteita, joita hallitsee kovalenttiset sidokset; Sen sijaan, että ne järjestetään diatomisiksi molekyyleiksi2, SE = SE, analoginen O: n kanssa2, O = O.
- Renkaat tai ketjut
Seleeniatomien omaksumien molekyylirakenteiden joukossa kaksi voidaan mainita yleisesti: renkaat tai ketjut. Huomaa, että SE: n hypoteettisessa tapauksessa3, Atomeja vaaditaan edelleen päissä; Siksi niiden on linkitettävä muihin atomeihin peräkkäin, kunnes ketju voidaan sulkea renkaassa.
Yleisimmät renkaat ovat kahdeksan jäsenen tai seleeniatomin renkaat:8 (Seleniitti kruunu). Miksi kahdeksan? Koska mitä pienempi rengas, sitä suurempi jännitys kärsii; Toisin sanoen niiden linkkien kulmat poikkeavat niiden SP -hybridisaatioiden asettamista luonnollisista arvoista3 (samanlainen kuin sykloalcanos).
Voi palvella sinua: Pascal -ruiskuAtomia on kahdeksan, se-atomien välinen erotus riittää, jotta niiden linkit ovat "rento" eikä "taitettu"; Vaikka sen linkkien kulma on 105,7 eikä 109,5. Toisaalta siellä voi olla pienempiä renkaita: i6 ja7.
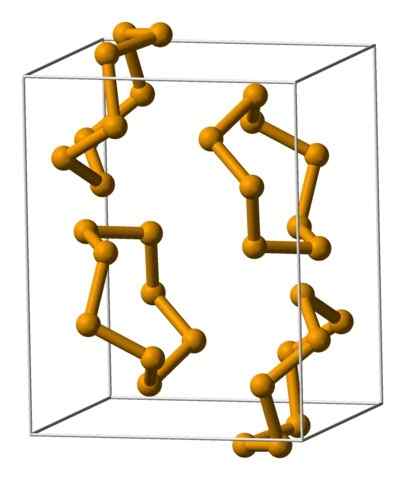 Seleeni Analeres -yksiköt, joita edustaa malli pallo- ja tankojen malli. Lähde: Benjah-BMM27 [julkinen alue].
Seleeni Analeres -yksiköt, joita edustaa malli pallo- ja tankojen malli. Lähde: Benjah-BMM27 [julkinen alue]. Yläkuvassa Analeres -yksiköt esitetään8. Huomaa samankaltaisuus, joka heillä on rikki kruunuilla; Vain he ovat isompia ja raskaita.
Renkaiden lisäksi seleeniatomit voidaan järjestää myös kierteisiin ketjuihin (ajattele etanan portaita):
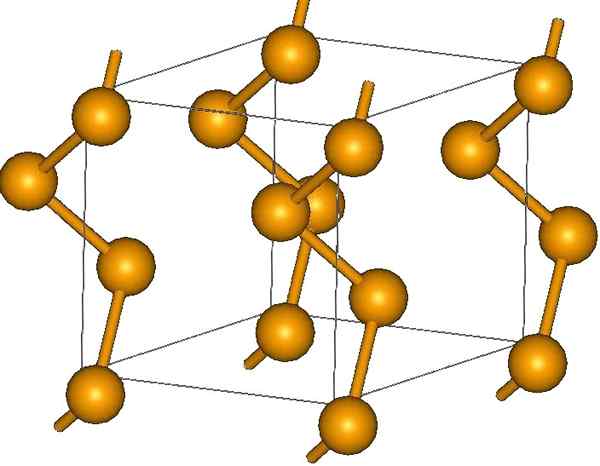 Kiereliketjut. Lähde: MaterialScientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Kiereliketjut. Lähde: MaterialScientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Sen päissä voi olla kaksoisliittimet (-Se = SE) tai renkaat ovat8.
- Alotrooppit
Kun otetaan huomioon, että seleenin kierteisiä renkaita tai ketjuja voi olla ja että niiden mitat voivat myös vaihdella niiden sisältämien atomien lukumäärän mukaan, on selvää, että tälle elementille on enemmän kuin yksi alotrooppinen; Tämä on puhdasta seleenin kiinteitä aineita, mutta erilaisilla molekyylirakenteilla.
Punainen seleeni
Seleenin näkyvimpiä alotrooppeja meillä on punainen, jotka voidaan esitellä amorfisena pölynä tai monokliinisinä ja polymorfisina kiteinä (katso renkaiden kuva ovat8-A.
Amorfisessa punaisessa seleenissä rakenteet ovat epäjärjestyksellisiä, ilman ilmeisiä malleja; Linssissä ollessaan renkaat luovat monokliinisen rakenteen. Kiteinen punainen seleeni on polymorfinen, jolla on kolme faasi: α, β ja y, jotka eroavat niiden tiheyksistä.
Musta seleeni
Mustan seleenin rakenne koostuu myös renkaista; Mutta ei kahdeksan jäsentä, mutta monet muut, tuhannen atomien renkaat ovat jopa renkaita (1000-A. Sitten sanotaan, että sen rakenne on monimutkainen ja koostuu polymeerisistä renkaista; Jotkut suuret tai pienet kuin toiset.
Kun on erikokoisia polymeerirenkaita, on vaikea odottaa rakenteellista järjestystä; Joten musta seleeni on myös amorfinen, mutta toisin kuin edellä mainitun punertavan pölyn kanssa, siinä on lasimaisia kontekstuureja, vaikka se on hauras.
Harmaa seleeni
Ja lopuksi, seleenin yksinkertaisimmista alotropeista on harmaa, joka erottuu muiden yläpuolella olemalla vakain normaaleissa olosuhteissa ja myös metallisella ulkonäöllä.
Heidän kiteensä voivat olla kuusikulmaisia tai trigonaalisia, jotka Lontoon dispersiovoimat ovat perustaneet heidän polymeeristen kierteisten ketjujen välillä (ylivoimainen kuva). Sen linkkien kulma on 130,1 º, mikä osoittaa tetraedristen ympäristöjen positiivisen poikkeaman (kulmat 109,5 °).
Siksi seleeni kierteiset ketjut antavat vaikutelman "avoimesta". Elekubraation avulla tässä rakenteessa atomit kohtaavat, joten teoriassa heidän orbitaaliensa on oltava suurempi päällekkäisyys ajobändejen luomiseksi.
Lämpö molekyylin värähtelyjen lisääntyessä vahingoittaa näitä nauhoja, kun ketjut ovat epäjärjestyksellisiä; Vaikka fotonin energia vaikuttaa suoraan elektroneihin, kiinnosta niitä ja edistää heidän liiketoimia. Tästä visiosta on "helppoa" kuvitella valonjohtavuus seleeniharmaalle.
Missä on ja tuotanto
Vaikka se on laajalti jakautunut, seleeni on harvinainen elementti. Se on alkuperäisessä tilassa, joka liittyy rikki- ja mineraaleihin, kuten eucairita (cuagse), cloustalita (PBSE), naumanite (AG AG2Se) ja crooKeesite [(cuttiag)2HÄN].
Seleeniä löytyy epäpuhtaukseksi, joka korvaa rikin pienessä osassa metallirikkimineraaleja; kuten kupari, lyijy, hopea jne.
On maaperää, jossa seleeniä on selenaatin liukoisessa muodossa. Niitä kuljettavat sateiden vedet jokiin ja sieltä kohti merta.
Jotkut kasvit kykenevät absorboimaan ja keskittymään seleeniin. Esimerkiksi Brasilian kuppi pähkinöitä sisältää 544 ug seleeniä, mikä vastaa 777% päivittäin suositellun seleenin määrästä.
Elävissä olennoissa seleeniä löytyy joistakin aminohapoista, kuten: selenometioniini, selenosysteiini ja metyyliselenosysteiini. Selenokysteiini ja seleniitti pelkistetään vety -seleniuroksi.
Kuparielektrolyysi
Seleenistä ei ole kaivostoiminnan hyödyntämistä. Suurin osa puhdistusprosessin toissijaisena tuotteena kuparin elektrolyysillä on anodissa kertymässä lieteessä.
Ensimmäinen askel koostuu seleenidioksidituotannosta. Tätä varten käsitellään natriumkarbonaatin anodista ohut. Sitten seleenioksidia lisätään vettä ja se on happamassa seleenihapon muodostamiseksi.
Lopuksi se on rikosdioksidin sukulainen happo sen pelkistyksen tuottamiseksi ja alkuaine -seleenin saamiseksi.
Toisessa menetelmässä rikkihapon tuotannossa muodostettua liete- ja muta -seoksessa saadaan epäpuhdas punainen seleeni, joka liukenee rikkihapossa.
Sitten muodostetaan selenarihappo ja selleniinihappo. Tämä seloninen happo saa saman hoidon kuin edellinen menetelmä.
Klooria voidaan käyttää myös, mikä vaikuttaa metallisiin Seleniuroihin haihtuvien seleenikloorattujen yhdisteiden tuottamiseksi; kuten: tiedän2Cl2, Seppari4, Seppari2 ja SEOCL2.
Voi palvella sinua: kemiallinen tasoNämä yhdisteet, vedessä suoritetussa prosessissa, muuttuvat seleenihapoksi, jota käsitellään rikkidioksidilla seleenin vapauttamiseksi.
Biologinen paperi
Puute
Seleeni on välttämätön jälki kasveille ja eläimille, joiden puutos ihmisillä on aiheuttanut vakavia häiriöitä, kuten Keshanin tautia; Sairaus, jolle on ominaista sydänlihavaurioita.
Lisäksi seleenin puute liittyy miesten hedelmättömyyteen ja voi olla rooli Kashin-Beckin taudissa, eräänlainen nivelrikko. Samoin nivelreumassa on havaittu seleenin puute.
Entsymaattinen kofaktori
Seleeni on antioksidanttivaikutuksen entsyymien komponentti, kuten glutataatioperoksidaasi ja tioresodoksiini reduktaasi, jotka vaikuttavat aineiden eliminoinnissa reaktiivisella happealla.
Lisäksi seleeni on kilpirauhashormonien desiodinaasien kofaktori. Nämä entsyymit ovat tärkeitä kilpirauhashormonien toiminnan säätelyssä.
Seleenin käyttö on osoitettu Hasimoton taudin, autoimmuunisairauden hoidossa, muodostumalla vasta -aineet kilpirauhasen soluja vastaan.
Seleeniä on käytetty myös elohopean myrkyllisten vaikutusten vähentämiseen, koska osa sen toimista on käytetty seleenistä riippuvaisiin antioksidanttientsyymeihin.
Proteiinit ja aminohapot
Ihmisellä on noin 25 seleenoproteiinia, joilla on antioksidanttivaikutus suojaamaan oksidatiivista stressiä vastaan, jonka aloittavat ylimääräinen reaktiiviset happilajit (ROS) ja reaktiiviset typpilajit (NI).
Ihmisillä on havaittu aminohappojen selenometytheoosiinin ja selenosysteiinin läsnäolo. Selenomectioniinia käytetään ruokavalion lisäyksenä seleenin puutevaltioiden hoidossa.
Riskejä
Korkealla seleenin kehon pitoisuudella voi olla lukuisia haitallisia vaikutuksia terveyteen, aloittaen haurasta hiuksista ja haurasta kynnistä, ihottumien, lämmön, ihon turvotuksen ja vaikean kivun kanssa.
Kun käsitellään seleeniä kosketuksessa silmiin, ihmiset voivat ilmaista armoa, ärsytystä ja kyyneliä. Samaan aikaan pitkäaikainen altistuminen savulle, jolla on korkea seleenipitoisuus, voi aiheuttaa keuhkojen turvotusta, valkosipulin hengitystä ja keuhkoputkentulehdusta.
Lisäksi henkilö voi kokea keuhkokuumeen, pahoinvointia, vilunväristyksiä, kuumetta, kurkkukipua, ripulia ja hepatomegalia.
Seleeni voi olla vuorovaikutuksessa muiden lääkkeiden ja ruokavalion lisäravinteiden, kuten antasidien, antineoplastisten lääkkeiden, kortikosteroidien, niasiinin ja pillereiden kanssa ehkäisymenetelmän kanssa.
Seleeniin on liitetty lisääntynyt riski ihosyövän suojelemiseksi. Kansallisen syöpäinstituutin tutkimuksessa todettiin, että miehillä, joilla oli korkea seleenin kehon pitoisuus, oli kaksinkertainen todennäköisyys kärsiä aggressiivisesta eturauhassyövästä.
Tutkimus osoittaa, että 200 µg: n seleenin päivittäinen saanti kasvaa 50% tyypin II diabeteksen kehittämismahdollisuuksien avulla.
Sovellukset
Kosmetiikka
Seleenisulfidia käytetään seborrhean, samoin kuin rasvan tai hilseiden käsittelyssä.
Lääkärit
Sitä käytetään vaihtoehtoisena lääketieteenä Hasimoton taudin, autoimmuunisen kilpirauhasen sairauden hoidossa.
Seleeni vähentää elohopean toksisuutta, jonka yksi sen myrkyllisistä aktiivisuuksista on käytetty deoksidantteihin entsyymeihin, jotka käyttävät seleeniä kofaktorina.
Mangaanin elektrolyysi
Seleenioksidin käyttö mangaanielektrolyysissä vähentää huomattavasti tekniikan kustannuksia, koska sähkökulutus vähenee.
Pigmentti
Seleeniä käytetään pigmenttinä maalauksissa, muovissa, keramiikassa ja lasissa. Seleenistä riippuen lasin väri vaihtelee syvän punaisesta vaalean oranssiin.
Valonjohtava
Harmaan seleenin ominaisuuden vuoksi sen säteilevän valon voimakkuuden mukaan sen säteilevän valon voimakkuudesta riippuen, seleeniä on käytetty valokopioissa, valokopioissa, fotometreissä ja aurinkokennoissa.
Seleenin käyttö kopiokoneilla oli yksi tärkeimmistä seleenisovelluksista; Mutta orgaanisten valojohteiden ulkonäkö on vähentänyt sen käyttöä.
Kiteet
Seleeniä käytetään lasin värjäytymiseen, raudan esiintymisen seurauksena, joka tuottaa vihreää tai keltaista väriä. Lisäksi se mahdollistaa lasin punaisen värin riippuen siitä, mitä haluat antaa sen.
Vulkanointi
Diettenio Dietteniumia käytetään kumituotteiden vulkanoivana aineena.
Seokset
Seleeniä käytetään yhdessä messingin vismutin kanssa lyijyn korvaamiseksi; Erittäin myrkyllinen elementti, joka on vähentänyt sen käyttöä terveysvirastojen suositusten vuoksi.
Seleeni lisätään alhaiseen pitoisuuteen teräs- ja kupariseoksiin näiden metallien helppokäyttöisyyden parantamiseksi.
Tasasuuntaajat
Seleenin tasasuuntaajia alettiin käyttää vuonna 1933 vuoteen 1970 -luvulle, jolloin ne korvattiin piikalla alhaisella kustannuksella ja korkeammalla laadulla.
Viitteet
- Australian kuninkaallinen kemian instituutti. (2011). Seleeni. [PDF]. Toipunut: Raci.org.Au
- Wikipedia. (2019). Seleeni. Haettu: vuonna.Wikipedia.org
- Sato Kentaro. (S.F.-A. Pääryhmäelementtien uudet allotroopit. [PDF]. Haettu: Tcichemicals.com
- DR. Taikina. (2019). Seleenielementit. Kemikooli. Toipunut: Chemicool.com
- Robert C. Räjähdysmäinen. (28. elokuuta 2019). Seleeni. Encyclopædia britannica. Toipunut: Britannica.com
- Marques Miguel. (S.F.-A. Seleeni. Toipunut: Nautilus.Fis.UC.Pt
- Helmestine, Anne Marie, PH.D -d. (3. heinäkuuta 2019). Seleeni -tosiasiat. Toipunut: Admingco.com
- Lentech b. V. (2019). Aikataulukko: Seleeni. Toipunut: lentech.com
- Tinggi U. (2008). Seleeni: sen rooli antioksidanttina ihmisten terveydessä. Ympäristöterveys ja estä lääketiede, 13(2), 102-108. Doi: 10.1007/S12199-007-0019-4
- Ruokavalion toimisto. (9. heinäkuuta 2019). Seleeni: Tosiasiat terveydenhuollon ammattilaisille. Kansallinen terveysinstituutti. Haettu: SDG.Od.NIH.Hallitus

