Iskunvaimentimet

- 2446
- 209
- Shawn Stanton II
Selitämme, mitkä ovat vaimennusratkaisut, niiden ominaisuudet, komponentit, tyypit ja annamme useita esimerkkejä
 Iskun absorboivat ratkaisut säätelevät pH: ta tietyn arvon ympärillä
Iskun absorboivat ratkaisut säätelevät pH: ta tietyn arvon ympärillä Mitkä ovat vaimennusratkaisut?
Se iskunvaimentimet, Kutsutaan myös puskurit, pH- tai puskurit -säätimet, ovat vesipitoisia liuoksia, jotka muodostuvat heikon hapon ja sen konjugaattipohjan tai heikon emäksen ja sen konjugoidun hapon kanssa.
Niitä kutsutaan iskunvaimennin liuoksille, koska niillä on kyky pehmentää pH: n muutosta happojen tai emäksen lisäämisen jälkeen pieninä määrinä, vaikka se olisi vahvoja happoja tai emäksiä.
Iskin absorboijaratkaisut ovat erittäin hyödyllisiä, koska ne sallivat pH: n vakiona. On monia kemiallisia reaktioita, jotka tarvitsevat spesifisen ja vakion pH: n toimimaan hyvin.
Morpainary -ratkaisujen ominaisuudet
Ne ovat vesipitoisia ratkaisuja
Sekä pH -konsepti että pH -asteikko ovat järkeviä vain vesipitoisissa liuoksissa, joten kaikki puskurit tai vaimennusliuokset valmistetaan vedessä.
Sen toiminta perustuu happo-emästasapainoon ja Le Chatlierin periaatteisiin
Puskurit perustuvat palautuviin happo/emäksen dissosiaatioreaktioihin, jotka ovat tasapainossa. Lisäämällä vahvoja happoja tai emäksiä ympäristöön, tämä tasapaino on häiriintynyt, joten järjestelmä reagoi häiriöiden torjumiseksi Le Catelierin periaatteiden mukaisesti. Näin puskurit onnistuvat pehmentämään pH: n suuria muutoksia.
PH-pH lasketaan helposti Henderson-Haselbalch-yhtälöllä
Riippumatta siitä, minkä tyyppinen iskunvaimennin liuos, sen pH sekä ennen kuin sen jälkeen lisäävät pieniä määriä vahvoja happoja tai emäksiä, se voidaan laskea Henderson-Hohaselbalch-yhtälön avulla:
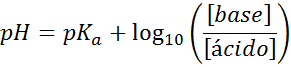
Jos [emäksinen] viittaa emäksen (tai konjugaattipohjan suolaan) molaariseen pitoisuuteen ja [happo] viittaa hapon (tai konjugoituneen hapon suolan) molaariseen pitoisuuteen.
Voi palvella sinua: elastiset materiaalitHe kykenevät neutraloimaan osittain sekä hapot että emäkset
Vaimennusliuokset koostuvat emäksisestä aineesta ja happosta, joka voi neutraloida emäkset ja hapot, vastaavasti. Tästä syystä he voivat pehmentää pH: ta sekä vahvojen happojen että vahvojen emäksen lisäämisen jälkeen.
Sen toiminta riippuu lämpötilasta
Puskuriliuoksen pH riippuu happamuuden happamuudesta tai emäksisestä vakiosta, jonka se sisältää. Tämä vakio riippuu lämpötilasta, joten näiden liuosten toiminta riippuu myös lämpötilasta.
Mitä keskittyneempi, sitä suurempi sen kyky pehmentää tai säätää pH: ta
Vaimennuskyky riippuu liuoksen kokonaiskonsentraatiosta suurempi kuin lisätty hapon tai vahvan emäksen lopullinen konsentraatio. Tästä syystä, mitä suurempi puskuriliuoksen kokonaispitoisuus, sitä suurempi sen kyky pehmentää happoja tai vahvoja emäksiä.
Vaimennus- tai puskuriliuoksen komponentit
Kemiallisesti vaimennusliuokset muodostavat vain kaksi komponenttia. Nämä komponentit voivat olla heikko happo sekoitettuna sen konjugaattipohjan suolan kanssa tai heikon emäksen sekoitettuna sen konjugoidun hapon suolan kanssa.
Näiden komponenttien hankkimiseksi samassa ratkaisussa on kaksi eri tapaa, kuten alla näemme:
1. Komponenttien sekoitusratkaisut puskurien valmistus
Tämä on suorin tapa valmistaa puskuriliuos. Tätä varten heikon hapon (esimerkiksi etikkahapon) ja konjugaatti emäksen suolan (esimerkiksi natriumasetaatin) erilliset liuokset valmistetaan erillisiä liuoksia). Sitten molemmat liuokset sekoittuvat vähitellen haluttuun pH: hon.
Se voi palvella sinua: Ion -ammonium (NH4+): Kaava, ominaisuudet ja käytöt
- Ratkaisut sekoittuvat vähitellen haluttuun pH: hon
2. Puskurien valmistus heikon hapon liuoksen osittaisella neutraloimalla
Tässä tapauksessa valmistetaan heikko happoliuos halutulla kokonaiskonsentraatiolla, ja sitten natrium- tai kaliumhydroksidia lisätään vähän vähän, kunnes haluttu pH saavuttaa.
Puskuriratkaisutyypit
Iskunvaimennin ratkaisut voidaan luokitella niiden hallussaan olevien komponenttien tai lopullisen pH: n mukaan.
Komponenttityyppien mukaan:
- Heikko ja konjugoitu peruspuskuri: Näissä tapauksissa pH riippuu PK: sta-lla heikko happo.
- Heikko emäspuskuri ja konjugoitu happo: Näissä tapauksissa pH riippuu PK: stab - heikko.
- Polyproottisen happosuolan puskuri: Joissakin tapauksissa sekä heikon hapon että sen konjugaattipohjan rooli ovat molemmat suoloja hapon osittaisesta neutraloinnista, jolla on useita protoneja, kuten rikkihappo tai fosfori.
Lopullisen pH: n mukaan:
Happamuudesta tai emäksisestä vakiosta riippuen puskuriliuos voi säädellä pH: n eri pH -alueiden ympärillä, mikä johtaa kolmen tyyppisiin puskuriin:
- Happopuskurit: Ovatko ne, jotka säätelevät pH: ta alle 7 -arvot. Ne valmistetaan heikkojen happojen kanssa, joiden PK-lla olla alle 7 tai heikkojen emäksen kanssa, joiden pkb - olla yli 7.
- Neutraalit puskurit: Ovat niitä, jotka säätelevät pH: ta noin 7. Ne koostuvat yleensä heikkoista hapoista tai emäksistä, joilla on PK-lla tai pkb - Lähes 7.
- Alkalipuskurit: Ovat niitä, jotka säätelevät pH: ta yli 7. Ne valmistetaan heikkojen happojen kanssa, joiden PK-lla olla suurempi kuin 7 tai heikkojen emästen kanssa, joiden PKb - on alle 7.
Esimerkkejä puskureista tai vaimennusratkaisuista
Etikkahappopuskuri/natriumasetaatti
Tämä on heikon hapon (etikkahappo) ja sen konjugaattipohjan (natriumasetaatin) suolan puskuri (natriumasetaatti). Mukana olevat tasapainon vakio ovat:
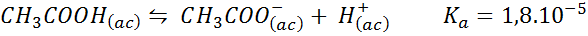
Tämä puskuri säätelee pH: ta ympäri 4.74.
Ammoniakkipuskuri/ammoniumkloridi
Tämä on heikko emäspuskuri (ammoniakki tai ammoniumhydroksidi) ja sen konjugoidun hapon (ammoniumkloridi) suola. Mukana olevat tasapainon vakio ovat:
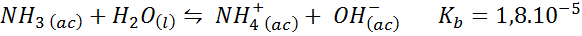
Tämä on emäksinen puskuri, joka säätelee pH: ta 9.26.
Bisulfaatti-/sulfaattipuskuri
Tässä tapauksessa bisulfaatti -ioni pelaa heikon hapon paperia, jonka konjugaattipohja on sulfaatti -ioni. Mukana oleva tasapaino on:
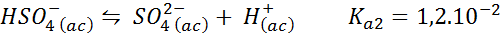
Tämä on hapan damsoiva liuos, joka säätelee pH: n ympärillä 3.05.
Hiilihappo/bikarbonaattipuskuri
Tämä on yksi veren tärkeimmistä pH -säätelyjärjestelmistä. Reaktio on: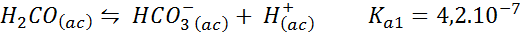
Tämä puskuri säätelee pH: ta ympäri 6.38.
Dihydrogeenipuskurifosfaatti/vetyfosfaatti
Tämä on yksi biologian ja biokemian eniten käytetyistä pH -säätelyjärjestelmistä, koska se mahdollistaa pH: n säätelyn hyvin lähellä fysiologista pH: ta, johon useimmat kemialliset reaktiot soluissa tapahtuu. Reaktio on:
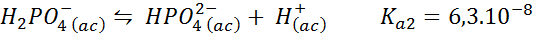
Tämä puskuri säätelee pH: ta ympäri 7.20.

