Natriumsulfaatti (Na2SO4) rakenne, ominaisuudet, käyttää, hankkimalla

- 1800
- 329
- Arthur Terry II
Hän natriumsulfaatti Se on epäorgaaninen suola, jonka kemiallinen kaava on Na2Sw4. Se koostuu valkoisesta kiinteästä, läsnä kolmessa muodossa: vedettömät, heptohydraatit (pienen olemassaolon) ja rappeutumisen (jota kutsutaan nimellä Glaubert Salt); Jälkimmäinen on natriumsulfaatin runsain muoto.
Natriumsulfaatti rappeutuneita, na2Sw4· 10H2Tai Glaubert löysi sen vuonna 1625 kevään vedessä, joka nimitti sen Salnabiliksen (ihmeellinen suola) sen lääkinnällisistä ominaisuuksista johtuen.
 Kellalasi natriumsulfaattinäytteellä. Lähde: Walkerma Wikipedian kautta.
Kellalasi natriumsulfaattinäytteellä. Lähde: Walkerma Wikipedian kautta. Natriumsulfaatilla on lukuisia sovelluksia tekstiili- ja paperiteollisuudessa sekä lasinvalmistuksessa. Sen käyttöä laajennetaan lämpösovelluksilla, jotka sisältävät lämmön ympäristöä ja kannettavien tietokoneiden jäähdytystä.
Natriumsulfaatti on alhaisen myrkyllisyyden ja sen haitallisten vaikutusten yhdiste, ne ovat pohjimmiltaan mekaanisia ja ei -kemiallisia. Kristallografisista syistä tämä suola, kuten sen runoilijan vastine, k2Sw4, esittelee kehys- ja polymorfiset rakenteet.
[TOC]
Rakenne
Vedetön suola
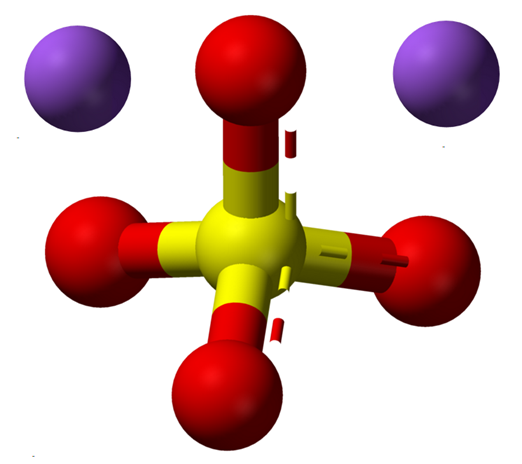 Vedettömät natriumsulfaatti -ionit. Lähde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Vedettömät natriumsulfaatti -ionit. Lähde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] NA -kaava2Sw4 Osoittaa, kun na -ionit suolakiteissä+ Ja niin42- He ovat 1: 2 -suhteessa; toisin sanoen jokaisesta kahdesta katiosta Na+ on niin anioni42- vuorovaikutuksessa heidän kanssaan sähköstaattisella vetovoimalla (ylivoimainen kuva).
Tietysti tämä koskee NA: ta2Sw4 vedettömät, ilman vesimolekyylejä, jotka on koordinoitu natriumin kanssa kiteiden sisällä.
 Natriumsulfaatti
Natriumsulfaatti Huolimatta siitä, että se on yksinkertainen ulkonäkö, sen kuvaus on rakenteellisesti monimutkainen. Sitten eräs2Sw4 Se esittelee polymorfismia, joilla on jopa viisi kiteistä vaihetta: I, II, III, IV ja V, joiden siirtymälämpötilat ovat vastaavasti 180, 200, 228, 235 ja 883 ºC,.
Vaikka sitä ei ole viitteitä, na ei ole2Sw4I sen on oltava se, jolla on kuusikulmainen kiteinen rakenne, tiheämpi verrattuna Na ortorromisiin2Sw4Iii, joiden kiteissä na+ Tetrahedra -muoto (NAO4) ja oktaedrot (NAO6) koordinaatio; eli sitä voidaan ympäröimä neljä tai kuusi anionia42-.
Rappeutuneiden suola
Samaan aikaan sen tärkeimmän hydraatin, Na2Sw4· 10H2Tai se on yksinkertaisempaa. Siinä käytännössä vesimolekyylit ovat vuorovaikutuksessa tai koordinoivat NA: n kanssa+ Oktaedra na (h2JOMPIKUMPI)6+, Niin42- tuskin edistänyt riittävää vakautta lasiin olemassaoloon kiinteässä vaiheessa.
Se voi palvella sinua: Ensimmäinen kemian vallankumousSen sulamispiste (32,38 ºC) paljon alhaisempi kuin vedettömän suolan (884 ºC) osoittaminen osoittaa, kuinka vesimolekyylit ja sen vetytilat heikentävät ionisia vuorovaikutuksia, vahvempia, NA: ssa2Sw4.
Ominaisuudet
Nimeä
-Natriumsulfaatti (IUPAC)
-Glouber -suola (kuivunut)
-Sala ihmeellinen (Decayroper)
-Dinatiosulfaatti.
Moolimassa
142,04 g/mol (anh¡dro)
322,20 g/mol (dakydraatti)
Fyysinen ulkonäkö
Valkoinen hygroskooppinen kiteinen kiinteä
Haju
Käymälö
Maku
Katkera ja suolaliuos
Tiheys
2 664 g/cm3 (vedetön)
1 464 g/cm3 (Dahydraatti)
Huomaa, kuinka kiteiden sisällä olevat vesimolekyylit aiheuttavat niiden laajentumisen ja vähentävät siksi niiden tiheyttä.
Sulamispiste
884 ºC (vedetön)
32,38 ºC (dekhydraatti)
Kiehumispiste
1.429 ºC (vedetön)
Vesiliukoisuus
4,76 g/100 ml (0 ºC)
13,9 g/100 ml (20 ºC)
42,7 g/100 ml (100 ºC)
Kaikki liukoisuusarvot vastaavat vedetöntä suolaa, joka on melko liukoinen veteen kaikissa lämpötiloissa.
Liukoisuus kasvaa äkillisesti välillä 0 ºC - 38,34 ºC, havaitsemalla, että tällä lämpötilan alueella liukoisuus kasvaa yli 10 kertaa. Kuitenkin 32,38 ºC: n liukoisuus on kuitenkin riippumaton lämpötilasta.
Se tapahtuu. Siksi tasapaino rappeutuneen suolan, anhydasuolan ja natriumsulfaatin tyydyttyneen liuoksen välillä.
Niin kauan kuin kolmivaiheinen tila ylläpidetään, lämpötila pysyy vakiona, mikä antaa lämpömittarien lämpötilan kalibroida.
Toisaalta heptahydraattisuolan liukoisuudet ovat:
19,5 g/100 ml (0 ºC)
44,0 g/100 ml (20 ºC)
Huomaa, että 20 ° C: ssa heptahydraattisuola on kolme kertaa liukoisempi kuin vedettömä.
Taitekerroin
1 468 (vedetön)
1 394 (dekhydraatti)
Vakaus
Stabiili suositelluissa säilytysolosuhteissa. Yhteensopimattomia vahvojen happojen ja emäksien, alumiinin ja magnesiumin kanssa.
Hajoaminen
Kun se kuumennetaan hajoamiseen, se emittoi rikkioksidin ja natriumoksidin myrkyllisen savua.
PHE
5 %: n vesiliuoksen pH on 7.
Reaktiivisuus
Natriumsulfaatti dissosioituu vesiliuoksessa 2 NA: ssa+ Ja niin42-, joka mahdollistaa sulfaatti -ionin yhdistämisen BA: n kanssa2+ Saostamaan bariumsulfaatti. Se käytännössä auttaa siirtämään vesinäytteiden barium -ioneja.
Voi palvella sinua: transaminointiNatriumsulfaatista tulee natriumsulfidi reaktiolla korkeissa lämpötiloissa hiilen kanssa:
Naa2Sw4 + 2 c => na2S +2 Co2
Glaubertin suola, Naso4.10H2O Reagoi kaliumkarbonaatin kanssa natriumkarbonaatin tuottamiseksi.
Sovellukset
Paperiteollisuus
Natriumsulfaattia käytetään paperimassan valmistuksessa. Sitä käytetään Kraft -paperin kehittämisessä, joka ei sisällä ligniiniä tai alistuu valkaisuprosessiin, syy siihen, joka antaa sille suuren vastarinnan. Lisäksi sitä käytetään pahvien valmistuksessa.
Pesuaineet
Sitä käytetään synteettisenä pesuaineen täyttömateriaalina kotona käytettäväksi, lisäämällä pesuainetta pintajännityksen vähentämiseksi.
Lasi
Sitä käytetään lasinvalmistuksessa pienten ilmakuplien läsnäolon vähentämiseksi tai eliminoimiseksi sulaan lasissa. Lisäksi eliminoi kuonan muodostumisen sulan lasinjalostusprosessin aikana.
Tekstiiliteollisuus
Natriumsulfaattia käytetään mordanttina, koska se helpottaa väriaineiden vuorovaikutusta kangaskuitujen kanssa. Detoydratoitua natriumsulfaattia käytetään väriaineen testissä.
Lisäksi natriumsulfaattia käytetään väriaineen laimennus- ja apuväriaineen tulostajana; kuten suorat väriaineet, rikkivärit ja muut puuvillavärjäykset, jotka suosittelevat. Sitä käytetään myös aineena, joka viivästyy silkin suorat väriaineet.
Lääke
Decahrid -natriumsulfaattia käytetään laksatiivina, koska se on vähän imeytynyt suolistossa, ja siksi se pysyy tämän valossa, mikä aiheuttaa tilavuuden lisääntymistä. Tämä stimuloi peristalttisten supistumisten kasvua, joka indusoi suolen pitoisuuden karkottamisen.
Natriumsulfaatti on vastalääke myrkytyksen hallitsemiseksi bariumilla ja lyijysuoloilla. Glaubert -suola on tehokas tiettyjen lääkkeiden poistamiselle liikaa. Esimerkiksi parasetamoli (asetoaminofeeni).
Lisäksi sitä käytetään huonojen elektrolyyttien toimittamiseen, joilla on läsnä isoosmoottisissa ratkaisuissa.
Kuivausaine
Natriumsulfaatti, koska se on inertti reagenssi, käytetään veden poistamiseen orgaanisista yhdistelmäliuoksista.
Raaka materiaali
Natriumsulfaattia käytetään raaka -aineena lukuisten aineiden tuottamiseksi, mukaan lukien: natriumsulfidi, natriumkarbonaatti ja ammoniumsulfaatti.
Voi palvella sinua: kaasukromatografiaSaada
Natriumsulfaatti saadaan louhinta- ja kemiallisilla reaktioilla.
Louhinta
On olemassa kolme malmia tai mineraaleja, joita hyödynnetään kaupallisella suorituskyvyllä: sittentita (na2Sw4), Mirabilita (NA2Sw4· 10H2O) ja glaubarita (na2Sw4· Tapaus4-A.
Espanjassa Gallerioiden ja pylväiden maanalainen kaivos. Samaan aikaan Glauberita saadaan avoimesti, suurilla lautat, jotka asetetaan mineraalisäiliöön.
Maasto valmistetaan matalan intensiteetin räjähdyksellä huokoisuuden tuottamiseksi, joka mahdollistaa natriumsulfaatin huuhtoutumisen. Tuotantofaasi esiintyy sprinklerien kastelulla, jossa on makea vettä Glauberitasta, jonka huuhtoaminen etenee laskevalla tavalla.
Natriumsulfaattisäiliö on kerätty, kalsiumsulfaattitähde täytetään.
Kemiallinen tuotanto
Natriumsulfaatti saadaan suolahapon tuotannon aikana kahden prosessin kautta: Mannheim -prosessi ja HardGrenave -prosessi.
Mannheim -prosessi
Se tehdään suurissa teräsuuneissa ja 6 m teräsreaktiotasolla. Reaktio tapahtuu natriumkloridin ja rikkihapon välillä:
2 NaCl +H2Sw4 => 2 HCl +NA2Sw4
HardReave -prosessi
Siihen sisältyy natriumkloridin, rikkioksidin, hapen ja veden reaktio:
4 NaCl + 2 niin2 + JOMPIKUMPI2 + 2 h2O => 4 HCl +NA2Sw4
Toiset
Natriumsulfaatti esiintyy neutralointireaktiossa natriumhydroksidin ja rikkihapon välillä:
2 naoh +h2Sw4 => Na2Sw4 + H2JOMPIKUMPI
Natriumsulfaatti on lukuisten yhdisteiden tuotannon sivutuote. Se uutetaan viskoosin ja sellofaanin tuotannon aikana purettujen nestemäisten jätteiden perusteella. Myös natriumdikromaatin, fenolien, boorihapon ja litiumkarbamaatin tuotannossa.
Riskejä
Natriumsulfaattia pidetään alhaisen myrkyllisyyden yhdisteenä. Se voi kuitenkin aiheuttaa joitain vahinkoja henkilölle, joka käyttää sitä sopimattomana.
Voit esimerkiksi aiheuttaa silmien ärsytystä, punoitusta ja kipua. Iholla se voi aiheuttaa ärsytystä ja allergiaa joillekin ihmisille. Sen nauttiminen voi aiheuttaa ruoansulatuskanavan ärsytystä pahoinvoinnilla, oksentelulla ja ripulilla. Ja lopuksi, sen hengitys aiheuttaa ärsytystä hengitysteissä.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Natriumsulfaatti. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2019). Natriumsulfaatti. Pubchem -tietokanta. CID = 24436. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- B -. N. Mehrotra. (1978). NA: n kiderakenne2Sw4III. Toipunut: rruff-2.geo.Arizona.Edu
- Glauberita-Thenardita (natriumsulfaatti). [PDF]. Palautettu: IgMe.On
- « Sinkkioksidirakenne (ZnO), ominaisuudet, käyttö, riskit
- Lactofenolin siniset ominaisuudet, koostumus, valmistelu, käyttö »

