Aromaattinen elektrofiilinen substituutiomekanismi ja esimerkit

- 3369
- 545
- Edgar VonRueden
Se Aromaattinen elektrofiilinen substituutio (Sear) Se on orgaaninen reaktio, jossa köyhä laji elektroneissa, ts. Tämä reaktio vastustaa alkeenien kärsimiä lisäyksiä, mikä osoittaa aromaattisuuden vaikutuksen bentseenin ja sen johdannaisten reaktiivisuuteen.
Elektrofiili, monta kertaa, syntyy saman molekyylimekanismin aikana, reagenssien seoksen tuote ja katalyytti, joka koostuu Lewisin haposta, esimerkiksi kaikki3 tai FECL3. Nämä katalyytit lisäävät elektrofiilin aviditeettiä aromaattisen renkaan elektronien avulla, kiihdyttäen siten reaktiota.
 Aromaattisessa elektrofiilisessä substituutiossa bentseenirengas hyökkää elektrofiiliin. Lähde: Gabriel Bolívar Molviewin kautta.
Aromaattisessa elektrofiilisessä substituutiossa bentseenirengas hyökkää elektrofiiliin. Lähde: Gabriel Bolívar Molviewin kautta. Ylemmässä kuvassa meillä on yksinkertainen esitys bentseenin elektrofiilisestä hyökkäyksestä elektrofiiliin ja+. Huomaa, että hyökkäys tulee yhden sen kaksoissidoksen elektroneista; Eli sear käynnistää konjugoidun π -järjestelmän elektronit.
Tämä reaktio mahdollistaa bentseenin ja muiden aromaattisten yhdisteiden hankkimisen substituentit, kuten OH -ryhmät, ei2, Sw3H, CL, BR, R, Cor, Coch3, muiden joukossa. Esimerkiksi fenoli syntetisoidaan SEAR: n kautta bentseenistä ja muista johdannaisista.
[TOC]
Aromaattinen elektrofiilinen substituutiomekanismi
Vaihe 1: elektrofyylihyökkäys
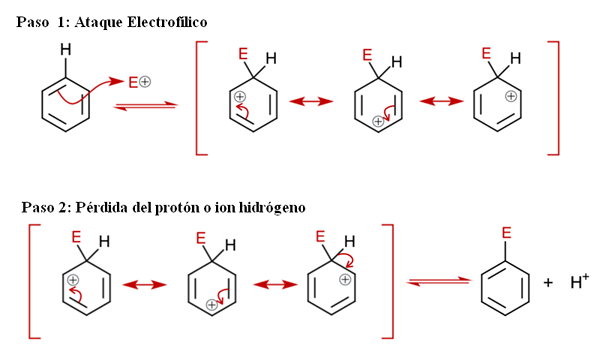 Yleinen mekanismi Searille. Lähde: Soonlorpai Wikipedian kautta.
Yleinen mekanismi Searille. Lähde: Soonlorpai Wikipedian kautta. Ylemmässä kuvassa aromaattisen elektrofiilisen korvaamisen mekanismi esitetään yksityiskohtaisemmin. Mikä tahansa bentseenin kolmesta kaksoissidoksesta hyökkää elektrofiiliin ja+, Ion -arenio -nimisen välittäjälajin muodostamiseksi (delokalisoitu sykloheksadien), lukittuna punaisissa suluissa.
Voi palvella sinua: kemiallinen saostuminenHuomaa, että E: n positiivinen kuorma+ Siirry nyt renkaan sisätiloihin. Mutta ei vain: se muuttaa kolmen hiiliatoman välillä ortossa (viereisessä) asennossa ja (vastapäätä) E (C-E). Tämä välittäjä esiintyy tarkasti sen resonanssirakenteiden antaman vakauden ansiosta.
Vaihe 2: Protonin tai vetyionin menetys
Arenio -ionin on kuitenkin pian neutraloitava positiivinen kuormitus häviämällä vetyprotonin tai ionin. Tässä korvaus huipentuu. Elektrofiil+ siksi korvaa yhden bentseenihydrogeista jättäen tämän ioniksi H+ renkaan ulkopuolella, niin että positiiviset maksut säilyvät.
Jos sitä havaitaan huolellisesti, kaikki vaiheet ovat tasapainossa, joten korvaaminen on palautuvaa. Eli jos H: n pitoisuudet kasvavat+, Sitten vety korvaa E: n ja saamme reagenssit uudelleen.
Esimerkkejä aromaattisesta elektrofiilisestä korvaamisesta
Bentseeni
Bentseeni -sear on yksinkertaisin kaikista, jo edellä esitetty. Mikä tahansa hydrogeneista voidaan korvata E: llä+, Koska kaikki ovat kemiallisesti vastaavia.
Toisistaan ei ole eroja. Siksi todennäköisyys, että korvaaminen tapahtuu yhdessä kuudesta hiiliatomista, on sama. Kaikki muuttuu kuitenkin, kun bentseenirenkaassa on muita korvaajia, kuten alla näemme.
Fenoli
Orto, ja tavoitehyökkäykset
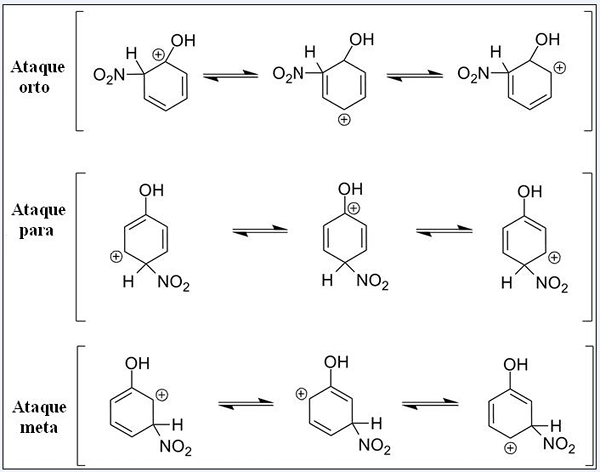 Fenolin resonanssirakenteet sen aromaattisessa elektrofiilisessä substituutioreaktiossa. Lähde: Pete Davis, julkinen alue, Wikimedia Commons
Fenolin resonanssirakenteet sen aromaattisessa elektrofiilisessä substituutioreaktiossa. Lähde: Pete Davis, julkinen alue, Wikimedia Commons Harkitse nyt fenolin seariä. Tällä kertaa sähköfyyrit ovat nitronian kationia, ei2+, joka linkittäessä bentseenirenkaan muuttuu nitro -ryhmään, -no2.
Voi palvella sinua: Nitraatit: Ominaisuudet, rakenne, nimikkeistö, koulutusNyt kun OH -ryhmä on läsnä, muut hydrogeenit lakkaavat olevan kemiallisesti vastaava; Jotkut ovat alttiimpia korvaamiseen kuin toiset. Ja lisäksi OH vaikuttaa suoraan tässä vaiheessa.
Ylös meillä on kolme substituutiota eri asemissa, jotka liittyvät OH: Ortho -hyökkäyksiin, ja tavoite. Huomaa, että kaikissa kolmessa meillä on hiekkakationi ja sen resonanssirakenteet. Orto -hyökkäyksissä ja varten positiivinen kuorma bentseenirenkaan sisällä sijaitsee aivan OH: hon kytkettyyn hiileen; Kohdehyökkäyksessä niin ei tapahdu.
Voi orto -ryhmänä ja ohjaajalle
OH tarjoaa kyvyn tuottaa elektroneja renkaaseen resonanssin ja induktion kautta. Molemmissa se voi auttaa ”häviämään” hiilen positiivisen kuormituksen, johon se on linkitetty, stabiloimalla vastaavasti rakenne. Päinvastoin, kun kohteen hyökkäys tapahtuu, OH ei voi vakauttaa positiivista kuormaa samalla tavalla, rakenne on epävakaampi.
Siksi Ortho hyökkää ja enemmän energiaa suositaan. Sitten sanotaan, että OH on orto-for-johtaja, joka voi myös aktivoida bentseenirenkaan kohti Seariä. Toisin sanoen fenoli reagoi paljon nopeammin kuin bentseeni, joka osoitetaan mittaamalla reaktion nopeudet.
Arilamiinit
 Aniliinin resonanssirakenteet sen aromaattisessa elektrofiilisessä substituutioreaktiossa. Lähde: V8RIK English Wikipedia, CC BY-SA 3.0, Wikimedia Commons
Aniliinin resonanssirakenteet sen aromaattisessa elektrofiilisessä substituutioreaktiossa. Lähde: V8RIK English Wikipedia, CC BY-SA 3.0, Wikimedia Commons Arilamiinien, kuten aniliinin (ylivoimainen kuva), tapaus on samanlainen kuin fenolin. Huomaa, että sen mekanismissa tällä kertaa typpiatomin positiivisen kuormituksen stabilointi (H2N+=), auttaen korvaamista suuntautumaan orto -asentoihin ja kuten OH: n kanssa.
Se voi palvella sinua: happobassiteoriat: Arrhenius, Bronsted-Lowry, LewisNyt aniliini on reaktiivisempi kuin fenoli elektrofiilistä substituutiota vastaan. Koska? Koska typpiatomi on vähemmän elektronegatiivinen kuin hapen, minkä vuoksi se antaa vapaiden elektronien parin helpommin aromaattiseen renkaaseen. Happi, koska se on elektronegatiivisempi, tuottaa yhden sen elektroniparista, joilla on vähemmän "avidity".
Myös typen atomisäde on lähempänä hiilen sädeitä. Tällä on vaikutusta siihen, että resonanssi tapahtuu etenkin atomien välillä, joilla on samanlaiset radiot tai koot. Siksi hiilen ja typen välinen resonanssi on hiukan stabiilempi ja tehokkaampi kuin hiilen ja hapen välinen.
Klorobentseeni
Kloorobentseenissä toisaalta CL: n atomi hidastaa substituutiota sen elektronegatiivisuuden vuoksi. Ja vaikka se kykenee myös luovuttamaan elektroneja renkaan resonanssista, sen atomisäde on huomattavasti suurempi kuin hiilen, vähentäen siten mainittua elektronista vaikutusta.
Kloorobentseeni reagoi vasteena 50 kertaa hitaammin kuin bentseeni, koska sen rengas on deaktivoitu kloorin takia. Ja myös houkuttelemalla elektroneja itseään kohti, kloori on kohderyhmä, joten substituutiot tapahtuvat pääasiassa siinä asennossa.
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10th Painos.-A. Wiley Plus.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Morrison ja Boyd. (1987). Orgaaninen kemia. (Viides painos). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Aromaattinen yhdiste. Haettu: vuonna.Wikipedia.org
- Ed Vitz et ai. (8. syyskuuta 2020). Aromaattiset hiilivedyt. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Wyman Elizabeth. (2020). Aromaattiset hiilivedyt: Määritelmä, esimerkki ja käyttö. Opiskelu. Toipunut: Opiskelu.com
- Boluda, c. J -., Macías, m., & González Marrero, J. (2019). Autoteollisuuden bensiinin kemiallinen monimutkaisuus. Tiede, tekniikka ja sovellukset,2(2), 51-79. Doi: doi.org/10.22206/CYAP.2019.V2I2.Pp51-79
- « Lämpöenergian ominaisuudet, hankkiminen, siirto
- Alumiinioksidirakenne, ominaisuudet, käytöt, nimikkeistö »

