Pintajännitys aiheuttaa, esimerkkejä, sovelluksia ja kokeita

- 4519
- 145
- Gustavo Runte DVM
Se pintajännitys Se on fyysinen ominaisuus, jota kaikki läsnä olevat nesteet ja jolle on ominaista vastus, jota niiden pinnat vastustavat alueensa kasvua. Tämä on sama kuin sanoa, että tämä pinta etsii vähiten mahdollista aluetta. Tämä ilmiö kietouttaa useita kemiallisia käsitteitä, kuten koheesio, tarttuvuus ja molekyylien väliset voimat.
Pintajännitys on vastuussa nesteiden pinnan kaarevuuden muodostumisesta putkimaisissa astioissa (asteittaiset sylinterit, pylväät, testiputket jne.-A. Nämä voivat olla kovera (laakson kaareva) tai kupera (kaareva kupoli). Monet fysikaaliset ilmiöt voidaan selittää ottaen huomioon nesteen pintajännityksen aiheuttamat muutokset.
 Lehtien vesipisaroilla käytetyt pallomaiset muodot johtuvat osittain niiden pintajännityksestä. Lähde: Valokuva: Flickr -käyttäjä Tanakawho [CC by (https: // creativecommons.Org/lisenssit/by/2.0)]
Lehtien vesipisaroilla käytetyt pallomaiset muodot johtuvat osittain niiden pintajännityksestä. Lähde: Valokuva: Flickr -käyttäjä Tanakawho [CC by (https: // creativecommons.Org/lisenssit/by/2.0)] Yksi näistä ilmiöistä on suuntaus, että nesteiden molekyylien on agglomeroitu tippojen muodossa, kun ne lepäävät pinnoilla, jotka torjuvat ne. Esimerkiksi lehtien yläpuolella näkevät vesipisarat eivät voi kostuta sitä sen mäen, hydrofobisen pinnan takia.
Kuitenkin tulee aika, jolloin painovoima käyttää roolia ja pudotus vuotaa kuin vesipylväs. Samankaltainen ilmiö esiintyy elohopean pallomaisissa tippaleissa, kun lämpömittari vuotaa.
Toisaalta pintavesijännitys on tärkein kaikista, koska se myötävaikuttaa ja järjestää mikroskooppisten kappaleiden tilan vesipitoisissa väliaineissa, kuten soluissa ja niiden lipidikalvoissa. Lisäksi tämä jännitys on vastuussa vedestä hitaasti haihtumisen ja joidenkin tiheimpien kappaleiden, jotka voivat kellua sen pinnalla.
[TOC]
Pintajännityksen syyt
Pintajännitysilmiön selitys on molekyylitasolla. Nesteen molekyylit ovat vuorovaikutuksessa keskenään, niin että ne ovat yhtenäisiä epätasaisissa liikkeissä. Molekyyli on vuorovaikutuksessa naapureidensa vieressä ja niiden yläpuolella tai sen alla olevien kanssa.
Tätä ei kuitenkaan tapahdu samoin nesteen pinnan molekyylien kanssa, jotka ovat kosketuksissa ilman (tai minkä tahansa muun kaasun) kanssa tai kiinteän kanssa. Pintamolekyylit eivät voi yhtenäistä ulkoisen ympäristön kanssa.
Seurauksena on, että heillä ei ole mitään voimaa, joka houkuttelee heitä; Vain alaspäin nestemäisen väliaineen naapureista. Tämän epätasapainon torjumiseksi pintamolekyylit "puristetaan", koska vasta sitten he onnistuvat voittamaan voiman, joka työntää ne alas.
Voi palvella sinua: Natriumsilikaatti (Na2Sio3): rakenne, ominaisuudet, käytöt, riskitSitten luodaan pinta, jossa molekyylit ovat jännittyneemmässä hävittämisessä. Jos hiukkas haluaa tunkeutua nesteeseen, sen on ensin ylitettävä tämä molekyyliesde, joka on verrannollinen mainitun nesteen pintajännitykseen. Sama koskee hiukkasia, joka haluaa paeta ulkoiseen ympäristöön nesteen syvyyksistä.
Siksi sen pinta käyttäytyy ikään kuin joustava kalvo, joka osoittaa epämuodostuman vastustuskykyä.
Yksiköt
Pintajännitys on yleensä esitetty y -symbolilla, ja se ilmaistaan N/M -yksiköissä, voima pituudella. Suurimman osan ajasta yksikkösi on kuitenkin dyn/cm. Yksi voi tulla toinen seuraavan muuntamiskertoimen kautta:
1 dyn/cm = 0,001 N/m
Pintavesijännitys
Vesi on länsi ja yllättävin kaikista nesteistä. Sen pintajännityksellä, samoin kuin useilla sen ominaisuuksilla, on epätavallisen korkea arvo: 72 dyn/cm huoneenlämpötilassa. Tämä arvo voi nousta 75,64 dyn/cm: iin, lämpötilassa 0 ºC; tai lasku 58,85 ºC: seen, lämpötilassa 100 ºC.
Nämä havainnot ovat järkeviä, jos katsotaan, että molekyylieste on jännittynyt vielä enemmän jäätymiskohdan lähellä olevissa lämpötiloissa tai "löysää" vähän enemmän kiehumispisteen ympärillä.
Vesillä on suuri pintajännitys sen vetysiltojen jälkeen. Jos nämä ovat tunnettuja nesteessä, ne ovat vielä enemmän pinnalla. Vesimolekyylit ovat voimakkaasti kietoutuneita muodostamalla tyypin H dipoli-dipolo-vuorovaikutukset2VOI VOI.
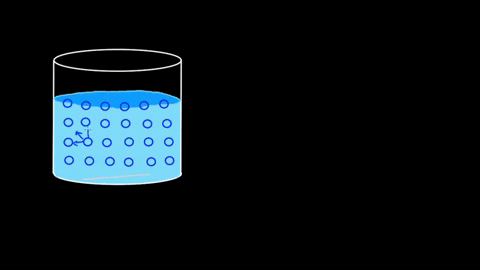 Vesimolekyylit houkuttelevat toisiaan; Ne yhdistävät vety sillat
Vesimolekyylit houkuttelevat toisiaan; Ne yhdistävät vety sillat Sen vuorovaikutuksen tehokkuus on sellainen, että vesipitoinen molekyylieste voi jopa ylläpitää joitain kehoja ennen kuin ne uppoavat. Sovellusten ja kokeiden osissa tätä kohtaa jatketaan.
Muita esimerkkejä
Kaikissa nesteissä on pintajännityksiä joko vähemmän tai suuremmassa asteessa kuin vesi tai jos ne ovat puhtaita aineita tai liuoksia. Kuinka vahvat ja kireät ovat niiden pinnallisten molekyyliesteet, se riippuu suoraan sen molekyylien välisistä vuorovaikutuksista rakenteellisten ja energiatekijöiden lisäksi.
Tiivistetyt kaasut
Esimerkiksi nestemäisen tilan kaasumolekyylit ovat vuorovaikutuksessa vain toistensa kanssa dispergoivien voimien kautta Lontoossa. Tämä on yhtä mieltä siitä, että niiden pinnallisilla jännitteillä on alhaiset arvot:
-Nestemäinen helium, 0,37 dyn/cm A -273 ºC
Se voi palvella sinua: ammoniumkloridi (NH4CL)-Nestemäinen typpi, 8,85 dyn/cm A -196 ºC
-Nestemäinen happi, 13,2 dyn/cm A -182 ºC
Nestemäisen hapen pintajännitys on suurempi kuin heliumin, koska sen molekyyleillä on suurempi massa.
Apolaariset nesteet
Apolaarisista ja orgaanisista nesteistä niiden odotetaan olevan suurempia pintajännityksiä kuin näiden tiivistettyjen kaasujen. Joidenkin joukossa meillä on seuraavat:
-Dietileter, 17 dyn/cm 20 ° C: ssa
-n-Heksaano, 18,40 dyn/cm 20 ºC: n lämpötilassa
-n-Oktaani, 21,80 dyn/cm 20 ° C: ssa
-Toluene, 27,73 dyn/cm 25 ° C: ssa
Näille nesteille havaitaan samanlainen suuntaus: pintajännitys kasvaa, kun sen molekyylimassa kasvaa. Kuitenkin n-Oktaanin tulisi tämän mukaan olla suurin pintajännitys eikä tolueeni. Täällä molekyylirakenteet ja geometriat tulevat peliin.
Tolueenilla, suunnitelmalla ja anillares -molekyyleillä on tehokkaampia vuorovaikutuksia kuin n-oktaani. Siksi tolueenin pinta on "kireä" kuin pinta n-oktaani.
Napa neste
Vahvempi dipoli-dipoli. Mutta se ei aina ole tilanne. Joidenkin esimerkkien joukossa meillä on:
-Etikkahappo, 27,60 dyn/cm 20 ºC: n lämpötilassa
-Asetoni, 23,70 dyn/cm 20 ºC: n lämpötilassa
-Veri, 55,89 dyn/cm 22 ° C: ssa
-Etanoli, 22,27 dyn/cm 20 ° C: ssa
-Glyseroli, 63 dyn/cm 20 ºC: n lämpötilassa
-Sulaa natriumkloridia, 163 dyn/cm 650 ºC: n lämpötilassa
-NaCl 6 M -liuos, 82,55 dyn/cm 20 ºC: n lämpötilassa
Sulan natriumkloridin odotetaan olevan valtava pintajännitys: se on viskoosinen ja ioninen neste.
Toisaalta elohopea on yksi nesteistä, joilla on korkein pintajännitys: 487 Dyn/cm. Siinä sen pinta koostuu voimakkaasti yhtenäisistä elohopeaatomeista, paljon enemmän kuin vesimolekyylit voivat olla.
Sovellukset
 Jotkut hyönteiset käyttävät veden pintajännitystä kävelemään sen päällä. Lähde: Pixabay.
Jotkut hyönteiset käyttävät veden pintajännitystä kävelemään sen päällä. Lähde: Pixabay. Pelkästään pinnallisista jännityksistä puuttuu sovelluksia. Tämä ei kuitenkaan tarkoita, että se ei ole mukana useissa päivittäisissa ilmiöissä, että jos niitä ei olisi, niitä ei tapahdu.
Esimerkiksi hyttyset ja muut hyönteiset pystyvät kävelemään veden läpi. Tämä johtuu siitä, että heidän hydrofobiset jalat hylkäävät veden, samalla kun heidän pieni massa mahdollistaa heille.

Pinnallinen jännitys kohtaa myös roolin nesteen kostutuksessa. Mitä suurempi sen pinnallinen jännitys, sitä vähemmän sen taipumus vuotaa materiaalin huokosten tai poikasten läpi. Tämän lisäksi ne ovat vähän hyödyllisiä nesteitä pintojen puhdistamiseen.
Voi palvella sinua: neutralointireaktioPesuaineet
Juuri täällä pesuaineet toimivat vähentäen veden pintajännitystä ja auttaen sitä peittämään suuremmat pinnat; Parantaa samalla rasvanpoistomenetelmääsi. Pienemällä sen pinnallista jännitystä, se mahtuu ilmamolekyyleihin, joiden kanssa kuplat muodostuvat.
Emulsiot
Toisaalta pienet suuremmat jännitteet liittyvät emulsioiden stabilointiin, erittäin tärkeitä eri tuotteiden valikoiman formuloinnissa.
Yksinkertaiset kokeet
 Metallipidike kelluu pintavesijännityksen vuoksi. Lähde: AlvesGaspar [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Metallipidike kelluu pintavesijännityksen vuoksi. Lähde: AlvesGaspar [CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Lopuksi, joihinkin kotimaan tilaan voidaan tehdä joitain kokeita.
Leike kokeilu
Lasissa, jossa on kylmä vesi, metallinen pidike asetetaan sen pintaan. Kuten ylemmästä kuvasta nähdään, pidike pysyy pinnalla veden pintajännityksen ansiosta. Mutta jos lasiin lisätään pieni laava -loza, pintajännitys vähenee dramaattisesti ja pidike uppoaa yhtäkkiä.

Paperivene
Jos meillä on paperialus tai puinen paletti, ja jos peset pienen tai pesuaineen, se lisätään tampon päähän, tapahtuu mielenkiintoinen ilmiö: siellä on mielenkiintoinen ilmiö, joka leviää ne reunoja kohti lasi. Paperin alus ja puupaletti siirtyvät pois pesuaineella paastosta.

Toinen samanlainen ja graafisempi koe on toistaa sama toimenpide, mutta mustalla pippurilla ruiskutettuna vettä. Mustapippurihiukkaset liikkuvat pois ja pinta menee pippurista kiteiseksi, reunojen reunojen ollessa.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Wikipedia. (2020). Pintajännitys. Haettu: vuonna.Wikipedia.org
- USGS. (S.F.-A. Pintajännitys ja vesi. Haettu: USGS.Hallitus
- Jones, Andrew Zimmerman. (12. helmikuuta 2020). Pintajännitys - Määritelmä ja kokeet. Toipunut: Admingco.com
- Susanna Lauren. (15. marraskuuta 2017). Miksi pintajännitys on tärkeä? Bioliinitieteellinen. Palautettu: blogi.Biolinscientific.com
- Aloittelija vanhemmuustiede. (7. marraskuuta 2019). Mikä on pintajännitys | Viileä tiedekoe. Toipunut: Rookieparenting.com
- Jessica Mock. (2020). Pintajännityskoe. Opiskelu. Toipunut: Opiskelu.com
- Lapsen pitäisi nähdä tämä. (2020). Seitsemän pintajännityskoetta - fysiikan tyttö. Toipunut: Thekidshouldseethis.com

