Molekyylin kiertoradan teoria

- 2871
- 233
- Edgar VonRueden
Mikä on molekyylin kiertoradan teoria?
Se Molekyylin kiertoradan teoria (Tom) Se on matemaattinen malli, joka on kehitetty selittämään molekyylien fysikaalis -kemialliset ominaisuudet, kuten säteilyn imeytyminen ja päästö, sähkönjohtavuus sekä sen linkkien elektroninen luonne. Tämä katsoo, että toisin kuin Valencia Link -teoria (TEV), että elektronit siirretään koko molekyylissä, ilman todennäköisyyden sijaitsevaa linkkejä.
Siksi molekyylin kiertoradan teoria sovelletaan samoja kvanttiperiaatteita, jotka määräävät atomien kiertoradan aaltofunktiot, mikä kuvaa siten atomien elektronien energiatilaa; Vasta nyt käsittelee niin kutsuttuja molekyyliorbitaaleja, jotka ovat peräisin lineaaristen atomien atomiorbitaalien lineaarisista yhdistelmistä.
 Nestemäisen hapen paramagnetismi ja siksi sen vetovoima magneetteihin selitetään molekyylin kiertoradan teorian ansiosta. Lähde: Pieter Kuipeper Wikipedian kautta.
Nestemäisen hapen paramagnetismi ja siksi sen vetovoima magneetteihin selitetään molekyylin kiertoradan teorian ansiosta. Lähde: Pieter Kuipeper Wikipedian kautta. Molekyylin kiertoradan teoria toimii silloin työskentelemällä molekyyliorbitaalien, niiden elektronisten ja alueellisten jakautumisten sekä niiden vastaavien energioiden kaavioiden kanssa, jotka mahdollistavat niiden energiaajojen tarkkailun, jotka erottavat ne erottavat. Ennen kaikkea selittää tiettyjen aineiden, kuten molekyylin happea nestemäisessä tilassa (katso yllä), paramagnetismi (ks.
O2, Lewisin rakenteiden ja Valencian linkkiteorian kuvaamia siinä on kaikki parilliset elektronit, joten teoriassa sen pitäisi olla diamagneettinen. Käytännössä on kuitenkin osoitettu, että se on todella paramagneettinen, ts. Siinä puuttuu elektroneja; erityisesti pari puuttuvia elektroneja.
OM -kaavion (molekyyliorbitaalien) rakentamisesta O: lle2, Homonukleaarinen diatominen molekyyli, voidaan nähdä, että siellä on tehokkaasti kaksi korkeaa energiaa puuttuvia elektroneja. Ei vain tämä, mutta näiden elektronien spin ja sijainti OMS: ssä selittävät myös muut tai2 (yksittäinen).
Molekyylin kiertoradan teorian tärkeimmät voitot ovat, että se auttaa ennustamaan diatomisten molekyylien mahdollisen olemassaolon sekä niiden suhteellisen stabiilisuuden. Siten molekyylin kiertoradan teoria on oikein molekyylien, kuten B, ennustamisessa2 ja Li2, Jopa silloin, kun he voivat havaita vain höyryvaiheessa korkeissa lämpötiloissa. Tämä teoria hylkää myös hypoteettisen olemassaolon2 tai NE2.
Tyypit molekyylisidokset ja orbitaalit
Kuten Valencia -linkkiteoria, molekyylin kiertoradan teoriassa tarkastellaan monen tyyppisiä linkkejä riippuen kemiallisesta sidokseen osallistuvien atomiorbitaalien päällekkäisyydestä riippuen. Molekyylin luonteen tärkeimpien ja läsnäolon joukossa meillä on sigma- ja pi -sidokset.
Sigma
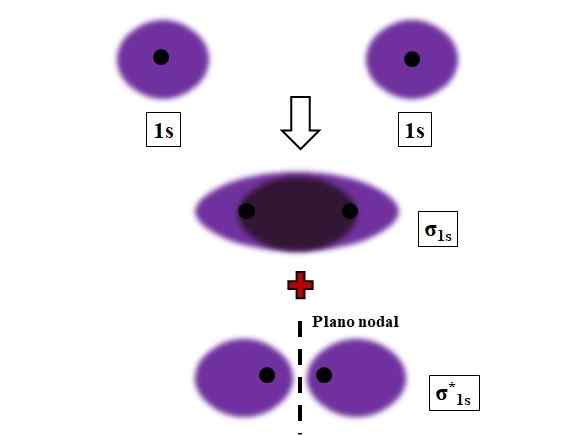 Σ1: n ja σ1: n* muodostuminen* linkittää kahden atomien kiertoradan päällekkäisyyden aikana 1s. Lähde: Gabriel Bolívar.
Σ1: n ja σ1: n* muodostuminen* linkittää kahden atomien kiertoradan päällekkäisyyden aikana 1s. Lähde: Gabriel Bolívar. Sigma, σ -sidokset määritetään, kun atomien kiertoradat ovat päällekkäisiä edessä, suhteessa kuvitteelliseen sisäiseen kirveen.
Tarkastellaan esimerkiksi σ -linkkiä, joka muodostuu, kun kaksi 1S -atomiarbitaalia, vetyatomin mukaan, on lähellä hyvin lyhytaikaista etäisyyttä (kuva yllä). Koska 1: n kiertorataa ovat symmetrisiä, niiden päällekkäisyys on aina etuosa; Siksi ne tuottavat aina molekyyliorbitaalit σ1s ja σ1s*.
Huomaa nyt, että molekyyliorbitaali σ1s Näyttää elektronisen tiheyden, joka on keskittynyt tilaan, joka erottaa kaksi ytimiä. Tämä tarkoittaa, että kiertoradalla σ1s Elektronin löytämisen todennäköisyys on maksimaalinen tällä molekyylin alueella. Σ: n elektronit1s Ne siirretään koko avaruuteen, joka kattaa violetin värin.
Toisaalta kiertoradalla σ1s* Meillä on solmutaso kahden ytimen välillä. Tämä tarkoittaa, että todennäköisyys löytää elektroni kyseisen tilan välillä on yhtä suuri kuin nolla. Huomaa, että kiertoradalla σ1s* Elektronit kuvaavat asentoja kahden ytimen ympärillä; ei kokonaisuutena molekyylin ympärillä.
Voi palvella sinua: Radio: Rakenne, ominaisuudet, käyttötarkoitukset, hankkiminenPilli
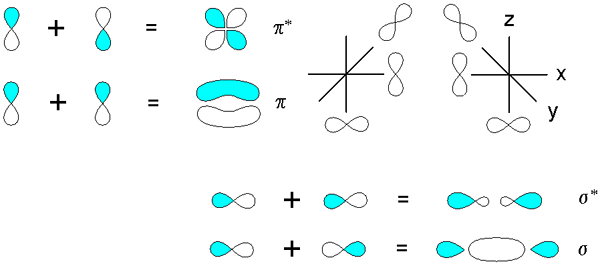 Sigma- ja pi -sidokset, jotka on johdettu kiertoratojen päällekkäisyydestä p. Lähde: V8RIK IN IN.Wikipedia, CC BY-SA 3.0, Wikimedia Commons
Sigma- ja pi -sidokset, jotka on johdettu kiertoratojen päällekkäisyydestä p. Lähde: V8RIK IN IN.Wikipedia, CC BY-SA 3.0, Wikimedia Commons Harkitse nyt molekyylisidoksia ja kiertoratoja. Nämä tapahtuvat, kun kiertoradan päällekkäisyys tapahtuu suuntaan kohtisuoraan suuntaan sisäiseen akseliin, joka on mielivaltaisesti kiinnitetty mihin tahansa kartesian tason akseliin. Olettaen, että puhumme 2p: n kiertoradanx, 2p kiertorataja Pi -linkin on vapaasti perustaa (katso sininen ja valkoinen lohko).
Kun kaksi kiertorataa 2pja Kaksi molekyylin kiertorataa on peräisin: π2py ja π2py*; Ensimmäisellä on korkein elektroninen tiheys ja sisäisen akselin alapuolella, kun taas toinen muistuttaa neljän ympyräkukkaa, jossa elektronien löytämisen todennäköisyys on paljon alhaisempi.
Toisaalta Orbitaalit 2p, sanoen 2px, Ne voivat myös olla päällekkäisiä etukäteen peräisin olevan σ -sidoksen ja kahden molekyylin kiertoradan σ2px ja σ2px*. Kuten σ -tapauksissa1s ja σ1s*, Kiertorata σ2px osoittaa suuremman elektronisen tiheyden kahden ytimen välillä; joka on vastakohta σ2px*, missä elektronit on suunnattu ulkopuolelle.
Linkki
Molekyyliorbitaalit ovat ne, jotka edistävät molekyylin stabiilisuutta. Eli niillä on oltava vähemmän energiaa verrattuna yksittäisten atomien atomiorbitaaleihin ennen molekyylin yhdistämistä ja muodostamista. Näissä orbitaaleissa elektronit siirtävät koko molekyylin mitat kokonaisuutena.
OM -kaavioissa nämä sijaitsevat aina atomiorbitaalien alapuolella, jotka yhdistyvät niiden muodostamiseksi. Tämä nähdään tarkemmin seuraavissa osissa.
Anti -hut
Toisaalta molekyylin kiertoradan vastaiset molekyyliorbitaalit ovat ne, jotka destabilisoivat molekyylin. Niitä symboloidaan tähdellä (*), ja niiden energiansa ovat korkeammat kuin heistä peräisin olevat atomien kiertoradat. Näissä orbitaaleissa elektronit siirretään melko epäsäännöllisesti, ikään kuin molekyyli olisi elektronisesti pirstoutunut.
OM -kaavioissa ne sijaitsevat aina atomiorbitaalien yläpuolella, jotka yhdistyvät niiden muodostamiseksi.
Ei linkitetty
Samaan aikaan ei -linkittämättömät orbitaalit, samoin kuin niiden elektronit, ovat ne, jotka eivät vaikuta tai vahingoita molekyylin stabiilisuutta. Hänen energiansa ovat hyvin samankaltaisia kuin atomien kiertoradalla.
Linkkitilaus
Linkkijärjestys tulee molekyyliorbitaalin teoriassa, samoin kuin linkkinumero on Valencia -linkkiteoriassa: linkin voiman mitta molekyylissä. Siten 1. Ja linkkitilaus (tai.e) yhtä suuri kuin 2, vastaa kaksoissidosta (=). Pian.
Tämä järjestys määritetään tietyn molekyylin OM -kaavioiden elektronien laskemisesta. Tätä varten on käytettävä seuraavaa kaavaa:
jompikumpi.E = (kytkettyjen elektronien lukumäärä - anti -hut -elektronien lukumäärä)/2
Link -elektronit edistävät molekyyliä stabiloimiseksi, kun taas perisillä anti -perisillä elektronit destabiloivat sitä. Siksi mitä enemmän anti -sung -elektroneja, sitä pienempi tai.E, ja molekyyli on yleensä erittäin epävakaa. Kun O.E on yhtä suuri kuin 0, se tarkoittaa, että molekyyliä ei ole (tai ainakin teoriassa).
OM -kaaviot
OM -kaavioissa molekyyliorbitaalien energiat ovat edustettuna, ja sen elektroninen täyttö on myös visualisoitu, mikä noudattaa aufbaufin ja Sinnin sääntöjä sekä Paulingin syrjäytymisen periaatetta. Harkitse esimerkiksi seuraavia kahta kaaviota:
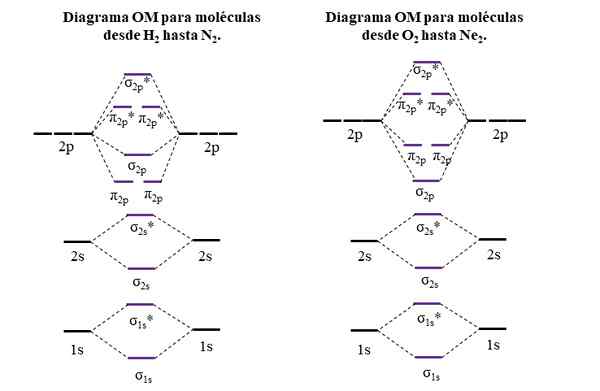 OM -kaaviot jaksollisen taulukon ensimmäisen ja toisen jakson molekyyleille. Lähde: Gabriel Bolívar.
OM -kaaviot jaksollisen taulukon ensimmäisen ja toisen jakson molekyyleille. Lähde: Gabriel Bolívar. Sivujen vaakasuorat viivat, mustat, edustavat atomien kiertoradan energioita. Sen sijaan keskikään vaakaviivat, violetti, ovat molekyyliorbitaalien energioita. Huomaa, kuinka linkitys ja anti -agent OMS jakautuvat (*) suhteessa yksittäisten atomien atomien kiertoradalle.
Se voi palvella sinua: aminoharja (NH2): rakenne, ominaisuudet, esimerkitHuomaa myös, että oikeassa kaaviossa OM σ2 p Ne muuttavat paikkaa π: llä2 p. Tämä tapahtuu O: n molekyyleillä2, F2, ja hypoteettinen NE2.
Esimerkit
Seuraavissa esimerkeissä OM jatkaa elektronien kanssa, laskee linkkijärjestyksen ja tekee ennusteita kyseisen molekyylin sidoksen voimasta tai stabiilisuudesta.
H2
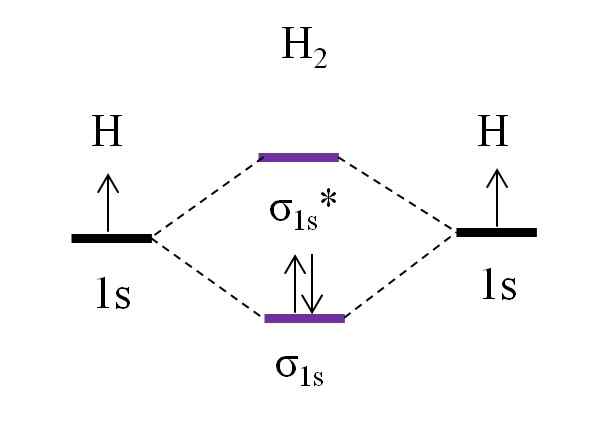 OM -kaavio dihydrogeenimolekyylistä. Lähde: Gabriel Bolívar.
OM -kaavio dihydrogeenimolekyylistä. Lähde: Gabriel Bolívar. Alkaen yksinkertaisimmasta molekyylistä, dihydrogeenista, H2, Kaksi H -atomia yhdistetään yhdistämällä niiden kaksi 1: n atomisiorbitaalia, jotka muodostavat kaksi molekyylin kiertorataa σ σ1s ja σ1s*. Kaksi elektronia jatkavat sitten molekyyliorbitaalien täyttämistä.
Ensinnäkin kiertorata σ on täytetty1s, Koska se on vähiten energiaa (Aufbauf -sääntö). Sitten toisen elektronin on lopetettava kiertoradan σ täytettävä1s Ennen kuin kiipeilee kiertoradalle σ1s* (Pesuallas sääntö). Ja lopuksi, tämä toinen elektroni ohjaa spininsä vastakkaiseen suuntaan kuin ensimmäistä elektronia (Paulingin syrjäytymisperiaate). Siten kaksi elektronia sijaitsevat kytkettynä kiertoradalla σ1s.
Entä linkkijärjestys? Link -molekyyliorbitaalissa σ1s Meillä on 2 elektronia; Ollessa anti -hell -molekyyliorbitaalissa σ1s* Meillä ei ole mitään. Siksi laskelma olisi:
jompikumpi.E = (2-0)/2
= 1
Oleminen tai.Ja yhtä suuri kuin 1, se tarkoittaa, että linkki, joka yhdistää kaksi vetyatomia, on yksinkertainen: H-H. Yleensä, jos tämä arvo on yhtä suuri tai suurempi kuin 1, sanotaan, että molekyyli on olemassa ja on vakaa.
Hän2
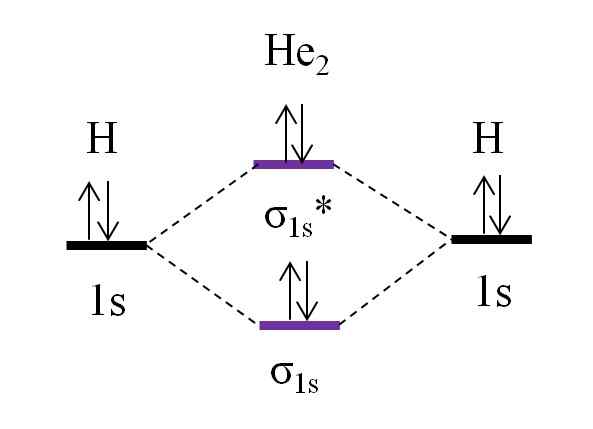 OM -kaavio hypoteettiselle dihelio -molekyylille. Lähde: Gabriel Bolívar.
OM -kaavio hypoteettiselle dihelio -molekyylille. Lähde: Gabriel Bolívar. Oletetaan nyt, että sinulla on HE -molekyyli2. Yllä näemme, että sen OM -kaavio on hyvin samanlainen kuin h2, 2 ylimääräisellä elektronilla, jotka sijaitsevat kiertoradalla σ1s*. Kun on yhteensä 4 elektronia, jotka lisäävät kaksi atomia, niin kaikissa tuloksena olevissa molekyyliorbitaalissa on oltava myös 4 elektronia.
O: n määrittäminen.E I HE: lle2 meillä tulee olemaan:
jompikumpi.E = (2-2)/2
= 0
Tämä tarkoittaa, että ei ole mahdollista yhteyttä, että kaksi helium -atomia. Itse asiassa tämän molekyylin olemassaoloa ei ole tunnistettu, mikä on yhtä mieltä molekyylin kiertoradan teorian ennusteista.
B -2
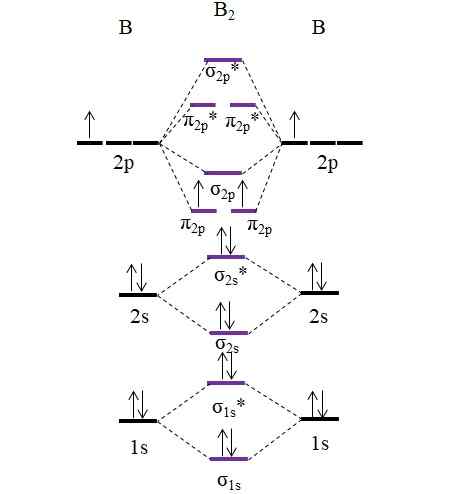 OM -kaavio B2 -molekyylistä. Lähde: Gabriel Bolívar.
OM -kaavio B2 -molekyylistä. Lähde: Gabriel Bolívar. Huomaa, että molekyyliorbitaalien muodostumisessa myös sisäisten kerrosten elektronit otetaan huomioon; Ei vain Valencian edustajat.
Siten Diboro -molekyylin esimerkissä B2, Jokainen booriatomi antaa yhteensä 5 elektronia, joista 3 on Valenciasta; Nämä ovat heidän 2s- ja 2p -kiertoradan. Orbitaalien 2p: n kaksi elektronia on sijoitettu eri molekyyliorbitaaleille π2 p Rinnakkaispiikillä (pesuallas sääntö).
Sitten jatkamme linkkijärjestyksen laskemista:
jompikumpi.E = (6-4)/2
= 1
Siksi molekyylin odotetaan olevan yksinkertainen B-B-linkki. B2 Se on molekyyli, joka esiintyy vain höyryvaiheessa erittäin korkeissa lämpötiloissa, koska boori normaaleissa olosuhteissa omaksuu monimutkaisempia verkkorakenteita ja malleja.
C2 ja c22-
Harkitse ensin molekyylin C OM -kaaviota2-
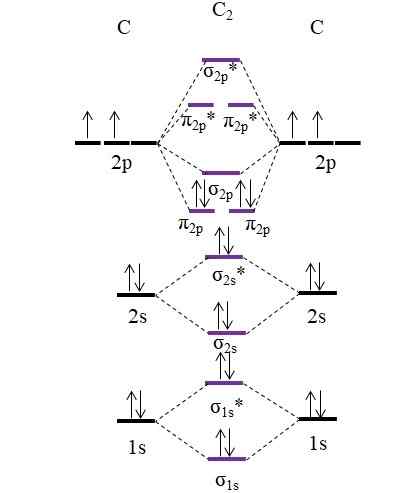 OM -kaavio molekyylille C2. Lähde: Gabriel Bolívar.
OM -kaavio molekyylille C2. Lähde: Gabriel Bolívar. Nyt hiiliatomien tarjoamat kaksi uutta elektronia sijoitetaan jälleen molekyyliorbitaaleihin π2 p Mutta vastakkaisilla pyörillä (Pauling -syrjäytymisperiaate).
Linkkitilauksen määrittäminen meillä on:
jompikumpi.E = (8-4)/2
= 2
Huomaa, että molekyyliorbitaalit π2 p Lisää 4 elektronia sidottu kaavaan. Koska tämä järjestys on yhtä suuri kuin 2, se tarkoittaa, että molekyyli C2 Sillä on kaksoissidos, c = c. Jälleen molekyyli C2, Kutsutaan myös diatomisiksi hiiliksi, korkeissa lämpötiloissa on vain höyryfaasi, ja se on yksi yksinkertaisimmista hiilen allotrooppisista muodoista.
Ja entä c22-? OM -kaavio on seuraava:
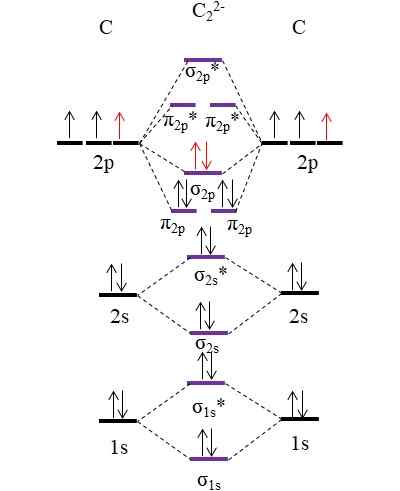 OM -kaavio anionille C22-. Lähde: Gabriel Bolívar.
OM -kaavio anionille C22-. Lähde: Gabriel Bolívar. Kaksi uutta elektronia (punaiset nuolet) on sijoitettu yhdistävään molekyyliorbitaaliin σ2 p. Tämä olettaa siten, että jokainen hiiliatomi edistää yhtä kahdesta negatiivisesta varauksesta (hapetustilaan -1).
Voi palvella sinua: Elohopea fulminate: rakenne, ominaisuudet, hankkiminen, käyttötarkoituksetLaskemalla linkkitilauksesi: Meillä on:
jompikumpi.E = (10-4)/2
= 3
Eli anioni c22-, Kutsutaan myös anioniasyyluroksi, sillä on kolminkertainen linkki, [C≡C]2-. Se on suhteellisen vakaa anioni, jolla on suuri linkkivoima; Vastine -ioneista riippuen se voi kuitenkin perustaa räjähtäviä yhdisteitä.
N2 ja n2+
Kuuluisa typpimolekyyli, n2, Sitä voidaan kuvata myös täydellisesti käyttämällä molekyylin kiertoratakaavioita:
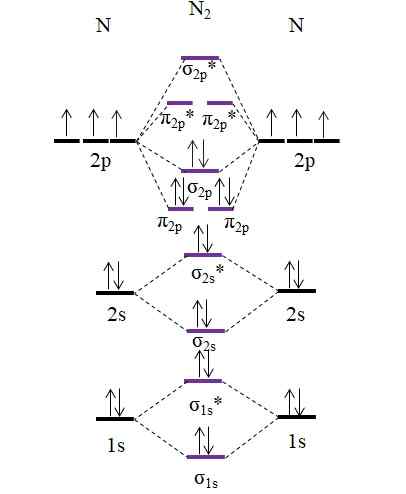 OM -kaavio N2 -molekyylistä. Lähde: Gabriel Bolívar.
OM -kaavio N2 -molekyylistä. Lähde: Gabriel Bolívar. Huomaa, että tämä kaavio on täsmälleen sama kuin anionilla C22-. Tämä tarkoittaa sitä n2 ja c22- Ne ovat isolektronisia. Tällainen tosiasia ei kuitenkaan tarkoita, että molemmat lajit käyttäytyvät samalla tavalla. N2, neutraali, on paljon vakaampi kuin c22-, negatiivinen, vaikka molemmilla on linkkitilaus, joka on yhtä suuri kuin 3, nÖn.
Ja entä kationi n2+? Katsotaanpa OM -kaaviota:
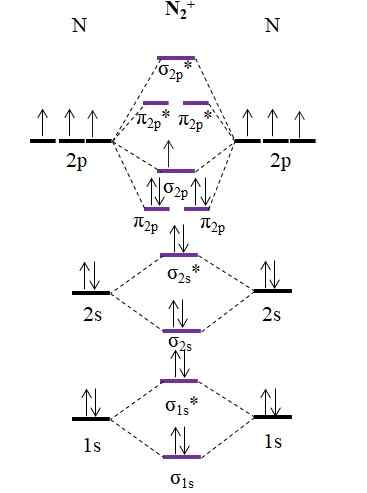 OM -kaavio kationille N2+. Lähde: Gabriel Bolívar.
OM -kaavio kationille N2+. Lähde: Gabriel Bolívar. Kuten kationi n2+ Siinä on yksi vähemmän elektronia, tämä poistetaan molekyylin kiertoradan σ2 p. N2 Se on diamagneettinen, kun taas n2+ Se on paramagneettinen. Ja hänen linkkijärjestyksensä on:
jompikumpi.E = (9-4)/2
= 2.5
2 2 linkki.5 esitetään kahdella viivalla ja yhdellä pisteellä. Tällaisella asialla ei kuitenkaan ole mitään järkeä Valencian teoriassa tai Lewisin rakenteissa. Koska tämä linkkijärjestys on alle 3, n: n linkin voima2+ on alempi kuin n2, Joten se on epävakaa.
JOMPIKUMPI2, JOMPIKUMPI22- Minä22+
Katsokaamme nyt toisen erittäin tärkeän elämän molekyylin: molekyyli- tai diatomisen hapen tai2. Valencian teorian ja Lewisin rakenteiden mukaan sen tulisi olla diamagneettinen; Mutta kokeellisesti sen on osoitettu olevan paramagneettinen, joten se on kadonnut elektronit jonnekin.
Alla vertaamme O: n OM -kaavioita2 ja ionit tai22- (oksidi) ja o22+ (Hapettuminen):
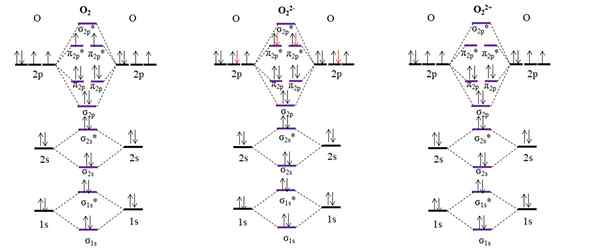 OM -kaaviot molekyylihapelle ja kaksi sen pääiomista. Lähde: Gabriel Bolívar.
OM -kaaviot molekyylihapelle ja kaksi sen pääiomista. Lähde: Gabriel Bolívar. O OM -kaavio O: lle2 Näyte, toisin kuin edelliset, että molekyyliorbitaalit σ2 p ja π2 p Muuta heidän energia -asemansa. Lisäksi näemme tehokkaasti, että kiertoradalla on kaksi puuttuvaa elektronia π2 p*, joka selittää hapen paramagneettisen luonteen (mainittu artikkelin alussa).
Toisaalta meillä on myös OM -kaavio anionille tai22-, äärettömästi levinnyt kosmossa (kuut, planeetat, komeetit, asteroidit jne.-A. Siinä on kaksi ylimääräistä elektronia (punaiset nuolet), jotka viimeistelevät π -kiertoradan täyttämisen2 p*, kaikkien elektronien pariutuminen. Näin ollen tai22- Se on diamagneettinen.
Tarkastelemme myös OM -kaaviota hapettumisen tai22+. Siinä on kaksi elektronia vähemmän kuin O2, tyhjentävät kiertoradat π2 p*. Kaikki sen elektronit ovat parillisia, ja siksi se on diamagneettinen.
Linkkitilaukset O: lle2, JOMPIKUMPI22- Minä22+ Ne ovat vastaavasti: 2 (o = o), 1 [o-o]2- ja 3 [o lähellä]2+. Siksi O22+ olisi vahvin linkki.
Hyödyt ja haitat
Edut
Molekyylin kiertoradan teorian eduista voimme mainita seuraavat:
-Se mahdollistaa linkkitilausten arvioinnin, joilla tavallisilla ei olisi paljon järkeä Valencia Link -teoriassa
-Se korreloi hyvin molekyylien diamagneettisuuden ja paramagnetismin kanssa
-Etäisyys, joka erottaa molekyyliorbitaalit kaavioissa
-Ei koske vain homonukleaarisia diatomisia molekyylejä, vaan myös heteronukleaarisia molekyylejä, kuten CO2 ja bentseeni
-Se laajentaa malliaan muun tyyppisiä yhdisteitä, kuten epäorgaanisia komplekseja, joten se tukee ligandien kentän teoriaa
-Huomio, että elektronit siirretään koko molekyylissä, on kätevä selittää monia fysikaalis -kemiallisia ominaisuuksia
Haitat
Ja joidenkin molekyylin kiertoradan teorian haittojen keskuudessa päättyy:
-Se on hyvin abstrakti ja vaatii syvän matemaattisen ymmärryksen sen ymmärtämiseksi täysin
-Molekyylikaaviot CO: na2, Co, h2Tai muut, ne voivat olla liian tylsiä kehittää ja selittää
-Hän ei sano mitään suuren molekyylin tietyistä alueista tai yhteyksistä
-Se ei myöskään tarjoa mitään tietoa molekyyligeometriasta (trigonaalinen taso, neliötaso, tetraedrinen jne.-A.
-Se ei ole niin graafinen kuin Valencian linkkiteoria
Molekyylin kiertoradan teoria on lopuksi teoria, joka täydentää Valencia -linkin teoriaa, jolla on laajempi ja täydellisempi panoraama molekyylispektristä.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Orbitalimolekyyliteoria. Haettu: vuonna.Wikipedia.org
- Stephen Lower. (7. syyskuuta 2020). Orbitalimolekyyliteoria. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Steven a. Kovettuja. (2017). Orbitalimolekyyliteoria. Haettu: Chemed.Kemia.Purduke.Edu
- Lehdistökirjat. (S.F.-A. Luku 8: Orbital -molekyyliteoria. Haettu osoitteesta: OpenTextbc.Ac

