Etyylieetteri

- 5081
- 937
- Shawn Stanton II
 Etyylieetteri on haihtuva ja syttyvä neste, joka toimi anestesiana 1800 -luvulla
Etyylieetteri on haihtuva ja syttyvä neste, joka toimi anestesiana 1800 -luvulla Mikä on etyylieetteri?
Hän etyylieetteri, Tunnetaan myös nimellä Dietyl -eetteri, se on orgaaninen yhdiste, jonka kemiallinen kaava on c4H10JOMPIKUMPI. Sille on ominaista väritön ja haihtuva neste, ja siksi sen pullot on pidettävä suljettuna mahdollisimman tiukasti.
Tämä eetteri. Eli heillä on ROR -kaava ', jossa R ja R' edustavat erilaisia hiilihapotettuja segmenttejä. Ja kuten sen toisella nimellä kuvataan, Dietyl -eetteri, ovat kaksi radikaalia -etyyliä, jotka on kytketty happiatomiin.
Aluksi etyylieetteriä käytettiin yleisenä anestesiana, jonka William Thomas Green Morton esitteli vuonna 1846. Syttyvyyden vuoksi sen käyttö hylättiin kuitenkin korvaamalla sen muilla vähemmän vaarallisilla anestesialla.
Tätä yhdistettä on käytetty myös verenkiertoajan laskemiseen potilaan sydän- ja verisuonitilan arvioinnin aikana.
Etyylieetterirakenne
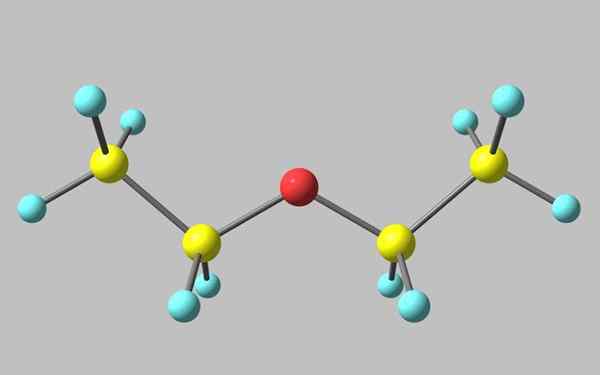 Etyylieetterin kemiallinen rakenne
Etyylieetterin kemiallinen rakenne Ylivoimaisessa kuvassa on esitys, jossa on etyylieetterin molekyylirakenteen pallo- ja tankojen mallia.
Kuten voidaan nähdä, Punaisella pallolla, joka vastaa happiatomia, on kaksi etyyliryhmää, jotka on kytketty molemmille puolille. Kaikki linkit ovat yksinkertaisia, joustavia ja vapaata kiertoa akselien ympärillä σ.
Nämä rotaatiot ovat peräisin stereoisomeereistä, jotka tunnetaan nimellä konformerit, jotka enemmän kuin isomeerit ovat vaihtoehtoisia alueellisia tiloja. Kuvasarakenne vastaa tarkalleen anti -konformoijaa, jossa kaikki sen atomiryhmät ovat porrastettuja (erotettu toisistaan).
Toinen kongruero on varjostettu, ja vaikka se ei ole sen käytettävissä oleva kuva, se riittää visualisoimaan sen u -muotoisella. U: n yläpäässä metyyliryhmät sijaitsevat, -CH3, joka kokeisi steerisiä väärennöksiä (ne törmäisivät avaruuteen).
Voi palvella sinua: Faraday ConstantSiksi voidaan odottaa, että CHO: n molekyyli3CH2Kisko2CH3 Hyväksy anti -muodostumisen suurimman osan ajasta.
Fysikaaliset ja kemialliset ominaisuudet etyylieetteri
Muut nimet
- Dietyylieetteri
- Etoksitani
- Etyylioksidi
Molekyylikaava
C4H10O o (c2H5-A2JOMPIKUMPI.
Molekyylipaino
74.14 g/mol.
Fyysinen ulkonäkö
Väritön neste.
Haju
Makea ja mausteinen.
Maku
Polttaa ja makea.
Kiehumispiste
94.34 (34.6 ° C) 760 mm Hg.
Sulamispiste
-177.3 ° F (-116.3 ° C). Vakaa kiteitä.
sytytyspiste
-49 ° F (suljettu astia).
Vesiliukoisuus
6.04 g/100 ml 25 ° C: ssa.
Liukoisuus muihin nesteisiin
Sekoittuu lyhyen ketjun alifaattisella, bentseenillä, kloroformilla, öljyeetterillä, rasvaliuottimella, monilla öljyillä ja konsentroituneella suolahapolla.
Liukoinen asetoniin ja erittäin liukoinen etanoliin. Se liukenee myös bensiiniin, bentseeniin ja öljyihin.
Tiheys
0 -.714 mg/ml 68 ° F (20 ° C).
Höyrytiheys
2.55 (tiheydellä 1 otetun ilmassa 1).
Höyrynpaine
442 mm Hg 68 ° F: ssa. 538 mm Hg 25 ° C: ssa. 58,6 kPa 20 ° C: ssa.
Vakaus
Se hapettuu hitaasti ilman, kosteuden ja valon vaikutuksesta peroksidien muodostumisella.
Peroksidien muodostuminen voi tapahtua eetterisäiliöissä, jotka ovat olleet avoimia ja pysyvät varastossa yli kuuden kuukauden ajan. Peroksidit voivat laukaista kitkan, iskun tai lämmityksen.
Sen kosketus: sinkki, halogeenit, ei -metalliset oksihalurot, voimakkaat hapettavat aineet, kromyylikloridi, treemiiniöljyt, nitraatit ja metallikloridit tulisi välttää.
Itset sytytys
356 ° F (180 ° C).
Hajoaminen
Kun hän lämmittää, hän hajoaa, säteilee hehtaarin ja ärsyttävän savua.
Goo
0 -.2448 POISE 20 ° C: ssa.
Palamislämpö
8.807 kcal/g.
Se voi palvella sinua: einstenio (t): rakenne, ominaisuudet, hankkiminen, käyttöHöyrystyslämpö
89.8 kalkki/g 30 ° C.
Pintajännitys
17.06 dynas/cm 20 ° C: ssa.
Ionisaatiopotentiaali
9.53 eV.
Hajukynnys
0 -.83 ppm (puhtautta ei anneta).
Taitekerroin
1.355 - 15 ° C.
Saada etyylieetteri
Etyyli -etyylialkoholista voidaan saada rikkihappoa katalyytin läsnä ollessa. Rikkihappo vesipitoisessa väliaineessa dissosioituu hydronium -ionin, H3JOMPIKUMPI+.
Vastakkaisessa prosessissa, ts. Etyleenin hydraatio höyryfaasissa, etyylieetteri voi muodostua vakuustuotteena etyylialkoholin lisäksi. Itse asiassa tämä synteettinen reitti tuottaa suurimman osan tästä orgaanisesta yhdisteestä.
Toksisuus jstk etyylieetteri
Se voi aiheuttaa ihon ja silmien ärsytystä. Ihon kosketus voi tuottaa sen resektion ja halkeilua. Eetteri ei yleensä tunkeudu ihoon, koska se haihtuu nopeasti.
Eetterin aiheuttama silmien ärsytys on yleensä lievää, ja vakavan ärsytyksen tapauksessa vauriot ovat yleensä palautuvia.
Sen nauttiminen aiheuttaa huumausainevaikutuksia ja vatsan ärsytystä. Vakava nauttiminen voi aiheuttaa munuaisvaurioita.
Eetterin hengitys voi aiheuttaa nenän ja kurkun ärsytystä. Eetterin hengityksen tapauksessa se voidaan tuottaa: uneliaisuus, jännitys, huimaus, oksentelu, epäsäännöllinen hengitys ja syljeneritys.
Korkea altistuminen voi aiheuttaa tiedon menettämistä ja jopa kuolemaa.
OSHA asettaa keskimäärin 800 ppm: n työvoiman altistumisrajan 8 tunnin vaihdon aikana.
Silmien ärsytystasot: 100 ppm (ihmiset). Silmien ärsytystasot: 1200 mg/m3 (400 ppm).
Käyttää/sovelluksia etyylieetteri
Orgaaninen liuotin
Se on orgaaninen liuotin, jota käytetään bromin, jodin ja muiden halogeenien liuottamiseen. Useimmat lipidit (rasvat), hartsit, puhtaat kumitit, jotkut alkaloidit, kuivia, hajusteita, selluloosa -asetaattia, selluloosa -nitraattia, hiilivetyjä ja väriaineita.
Se voi palvella sinua: ei metalleja: historia, ominaisuudet, ryhmät, käyttötarkoituksetLisäksi sitä käytetään eläin- ja kasvien kudosten aktiivisten aineosien uuttoon, koska sen tiheys on vähemmän kuin vedellä ja kelluvilla, jättäen halutut aineet liuenneen eetteriin.
Nukutus
Sitä on käytetty yleisenä anestesiana vuodesta 1840 lähtien, korvaavan kloroformin terapeuttisen edun saamiseksi. Se on kuitenkin syttyvä aine, ja siksi se löytää vakavia vaikeuksia sen käytössä kliinisillä alueilla.
Lisäksi se tuottaa potilailla joitain ei -toivottuja postoperatiivisia sivuvaikutuksia, kuten pahoinvointia ja oksentelua.
Näistä syistä eetterin käyttö on hylätty yleiseksi anestesiaksi, korvaamalla sen muilla anestesialla, kuten Halotano.
Eetteriryhmä
Eetterin sekoitettu etanoli.
Verenkierron arviointi
Eetteriä on käytetty arvioimaan verenkiertoa yhden käsivarren ja keuhkojen välillä. Eetteri injektoidaan käsivarteen, ottaen veri oikealle eteiselle, sitten oikealle kammiolle ja sieltä keuhkoihin.
Aika, joka kuluu eetterin injektiosta eetterin hajun sieppaamiseen uloshengitetyssä ilmassa, on noin 4 - 6 s.
Opetuslaboratoriot
Eetteriä käytetään laboratorioiden opettamisessa monissa kokeissa. Esimerkiksi Mendelin genetiikan lakien osoittamisessa.
Eetteriä käytetään sukupuolen kärpästen tunnistamiseen Drosophila ja salli tarvittavat ristit niiden välillä, korostaa genetiikan lakeja.
Viitteet
- Graham Solomons t.W -., Craig B. Freedle. Orgaaninen kemia. Amiini. Wiley Plus.
- Ethher -eetteri. Toipunut Britannicasta.com

