Ziehl-Neelsen-värjäys
- 1409
- 16
- Edgar VonRueden
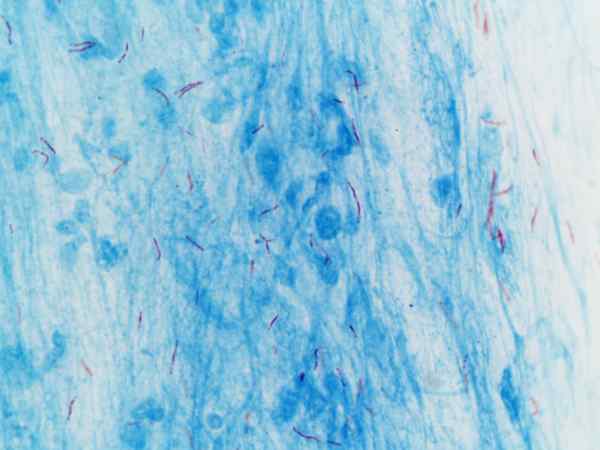
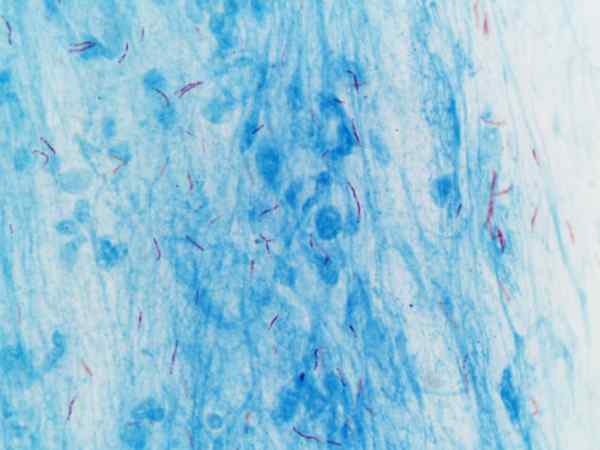 Mycobacterium tuberculosis visualisoitu Ziehl-Neelsenin värjäytymisellä
Mycobacterium tuberculosis visualisoitu Ziehl-Neelsenin värjäytymisellä Mikä on Ziehl-Neelsenin värjäys?
Se Ziehl-Neelsen-värjäys Väritystekniikassa kestävien alkoholihapon mikro-organismien (AAR) tunnistamiseksi. Tämän mikrobiologiamenettelyn nimi viittaa sen kirjoittajiin: bakteriologi Franz Ziehl ja patologi Friedrich Neelsen.
Tämä tekniikka on differentiaalinen värityyppi, joka merkitsee erilaisten väriaineiden käyttöä kontrastin luomiseksi rakenteiden välillä, joita halutaan tarkkailla, erottaa ja myöhemmin tunnistaa. Ziehl-Neelsenin värjäys palvelee tietyntyyppisiä mikro-organismeja.
Jotkut näistä mikro -organismeista ovat mykobakteereja (esimerkiksi, Mycobacterium tuberkuloosi), Nocardias (esimerkiksi, Nocardia SP.) ja joitain yksisoluisia loisia (esimerkiksi, Cryptosporidium parvum-A. Monet bakteerit voidaan luokitella yhteisen tekniikan avulla, nimeltään gram -värjäys.
Jotkut bakteeriryhmät vaativat kuitenkin muita menetelmiä niiden tunnistamiseksi. Tekniikat, kuten Ziehl-Neelsen-värjäys, vaativat lämpöyhdistelmiä lämmöllä ensimmäisen kiinnittämiseksi soluseinään.
Sitten tulee värimuutosprosessi, joka mahdollistaa kahden tulos.
Perusta
Tämän värjäystekniikan perusta perustuu näiden mikro -organismien soluseinämän ominaisuuksiin. Seinä muodostuu tyyppisellä rasvahapoilla, joita kutsutaan mykolihapoiksi; Näille on ominaista esitellä erittäin pitkiä ketjuja.
Kun rasvahapoilla on erittäin pitkät rakenteet, ne voivat pitää väriaineet helpommin. Joitakin bakteerien tyylilajeja on erittäin vaikea värjätä Gram -värjäyksellä, koska mykolihapon korkea pitoisuus soluseinämästä.
Ziehl-Neelsen -värjäyksessä käytetään fuchsiin-karbolifenoliyhdistettä, emäksistä väriainetta. Tällä on kyky olla vuorovaikutuksessa soluseinämän rasvahappojen kanssa, mikä on Cerosan tekstuuria huoneenlämpötilassa.
Voi palvella sinua: monosakkariditFuchsiin -karbolin värjäys paranee lämmön läsnä ollessa, koska vaha sulaa ja väritysmolekyylit liikkuvat nopeammin soluseinämään.
Myöhemmin käytetty happo käyttää soluja, joita ei värjätty, koska niiden seinä ei liittynyt väriaineen; Siksi happahapon voima kykenee poistamaan happoväriaineen. Soluja, jotka kestävät tätä värimuutosta, kutsutaan happaresistentteiksi.
Toissijainen väriaine
Näytteen värimuutoksen jälkeen tämä on ristiriidassa toisella väriaineella, nimeltään toissijainen väriaine. Sulaileon sinistä tai malakiittivihreää käytetään yleensä.
Toissijainen väriaine värjää taustamateriaalin ja luo näin ollen vastakohtana rakenteisiin, jotka oli värjätty ensimmäisessä vaiheessa. Vain värjäytyneet solut absorboivat toisen väriaineen (vasta-setti) ja ottavat niiden värin, kun taas happohappojen kestävät solut säilyttävät punaisen värin.
Tätä menettelyä käytetään usein tunnistamiseen Mycobacterium tuberkuloosi ja Mycobacterium leprae, joita kutsutaan kestäviksi happo-alkoholiksi.
Reagenssit
Ensisijainen väriaine
Käytetään 0,3 % fuchsiinikarbolia (suodatettu). Tämä väriaine on valmistettu alkoholiseoksesta: etanolifenoli (90 %) tai metanoli (95 %), ja tässä seoksessa 3 grammaa emäksistä fuchsiinia liukenevat.
Keksinratkaisu
Tässä vaiheessa voit käyttää 3 % alkoholihappoliuoksia tai 25 % rikkihappoa.
Toissijainen väritys (kaulat)
Näytteiden eniten käytetty väriaine on yleensä 0,3 % metyleenisininen. Toisia voidaan kuitenkin käyttää myös, kuten 0,5 % malakiittivihreä.
Voi palvella sinua: TiminaTekniikka
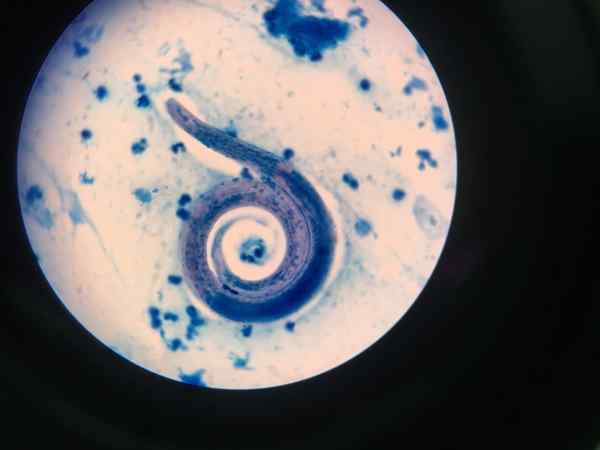 Nematodi näytetään Ziehl-Neelsenillä
Nematodi näytetään Ziehl-Neelsenillä Happokäyttöinen värjäysmenettely
Valmista bakteerien levitys
Tämä valmistus tehdään puhtaalla ja kuivalla liukumäellä steriiliys varotoimenpiteiden mukaisesti.
Frovisin kuivaus
Anna levityksen kuivua huoneenlämpötilassa.
Kuumenna näyte
Näyte on lämmitettävä levittämällä tulipalo alla olevaan liukuun. Alkoholin kiinnitys voidaan tehdä, kun haju ei ole valmistettu ysköllä (käsitellyt natriumhypokloriittia valkaisua varten) ja jos sitä ei tule värjätä välittömästi.
M. tuberkuloosi poistetaan valkaisuaineella ja värjäysprosessin aikana. Ei -hoidon olosuhteet eivät tappaa M. tuberkuloosi, Alkoholin kiinnitys on bakterisidia.
Peittää tahra
Verra on peitetty Fuchsiin -karboliliuoksella (ensisijainen perusväritys).
Lämmitä tahra
Tämä tehdään 5 minuutin ajan. Sinun tulisi huomata höyryn irrottaminen (noin 60 ° C). On tärkeää olla ylikuumentamatta ja välttää näytteen polttaminen.
Storin lämmittämisen suhteen sinun tulee olla erittäin varovainen kuumennettaessa fuchsiin -karbolia, varsinkin jos värjäys suoritetaan tarjotin tai muun astian päälle, joissa edellisestä värjäyksestä on kerätty erittäin syttyviä kemikaaleja.
Levyjen alle tulisi levittää vain pieni liekki käyttämällä tampovalaistusta, joka on aikaisemmin kostutettu muutamalla tipoilla happamaa alkoholia, metanolia tai 70 -prosenttista etanolia. Vältä etanolissa kastetun suuren tampon käyttöä, koska tämä on tulen riski.
Pestä tahra
Tämä pesu on tehtävä puhtaalla vedellä. Jos vesijohtovesi ei ole puhdas, pese hieronta suodatetulla tai tislatulla vedellä, mieluiten.
Peitä levitys hapolla alkoholilla
Tämän happaman alkoholin on oltava 3 %. Peitto suoritetaan 5 minuutin ajan tai kunnes haju on riittävän väriltään, toisin sanoen vaaleanpunainen.
Voi palvella sinua: EpiblastOn otettava huomioon, että happama alkoholi on syttyvää; Siksi sitä tulisi käyttää erittäin huolellisesti. Vältä olemista lähellä sytytyslähteitä.
Pestä tahra
Pesun tulisi olla puhtaalla, tislatulla vedellä.
Peittää levitys väriaineella
Se voi olla malakkiittivihreä väritys (0,5 %) tai metyleeninsininen (0,3 %) 1 tai 2 minuutin ajan, käyttämällä kovempaa aikaa, jos haju on ohut.
Pestä tahra
Puhtaita vettä (tislattua) tulisi käyttää uudelleen.
Tyhjentää
Liukun takaosa on puhdistettava ja tahra asetetaan viemärihyllylle niin, että se kuivuu ilmaan (ei käytä imukykyistä paperia kuivaamiseen).
Tutki mikroskoopin sadetta
100x: n ja upotusöljyn tavoitetta tulisi käyttää. Skannaa tahri systemaattisesti ja kirjoita asiaankuuluvat havainnot.
Tulkita tuloksia
Teoriassa punertavan väristä värjättyjä mikro -organismeja pidetään positiivisena alkoholihappona (AAR+).
Päinvastoin, jos mikro-organismit ovat värjätty sinisiksi tai vihreiksi, riippuen kauluksina käytetystä väriaineesta, niitä pidetään negatiivisena resistenttinä happona (AAR-).
Viitteet
- Apuba, S. & Sandhya, b. (2016). Käytännön mikrobiologian olennaiset (1. ed.-A. Jaypee Brothers Medical Publishers.
- Bauman, r. (2014). Mikrobiologia Deseodasin kanssa kehojärjestelmällä (4. ed.-A. Pearson Education, Inc.
- Heritage, J., Evans, E. & Killington, a. (1996). Johdanto -mikrobiologia (1. ed.-A. Cambridge University Press.
- Morello, J., Granato, p. Wilson, m. & Morton, V. (2006). Laboratoriokäsikirja ja mikrobiologian työkirja: Sovellukset potilaan hoitoon (11. ed.-A. McGraw-Hill-koulutus.
- Vasanthakumari, r. (2007). Mikrobiologian oppikirja (1. ed.-A. B -.Yllyttää. Julkaisut Pvt.

