Treonine -ominaisuudet, toiminnot, hajoaminen, edut
- 930
- 139
- Eddie Hackett
Se Treonina (THR, T) tai TREO-α-amino-β-butrisihappo on yksi soluproteiinien ainesosista aminohappoja. Koska ihmisellä ja muilla selkärankaisilla eläimillä ei ole biosynteettisiä reittejä sen tuotantoon, Treonine pidetään yhtenä yhdeksästä välttämättömästä aminohaksosta, jotka on hankittava ruokavaliossa.
Treonine oli viimeinen 20 proteiineista löydetystä yleisestä aminohapposta, mikä tapahtui historiassa yli vuosisadan asparagiinin löytämisen jälkeen (1806), joka oli ensimmäinen kuvattu aminohappo.
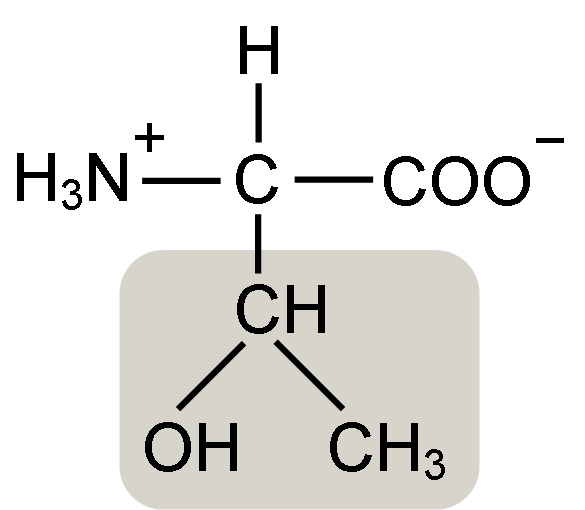
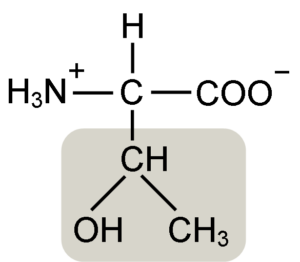 Treonine-aminohapporakenne (lähde: Keykiini [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Treonine-aminohapporakenne (lähde: Keykiini [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) William Cumming Rose löysi sen vuonna 1936, joka keksi termin "treonine" rakenteellisesta samankaltaisuudesta, jonka hän löysi tämän aminohapon ja haraonihapon välillä, yhdiste, joka on johdettu treosisokerista.
Aminohappoproteiinina trooniinilla on useita toimintoja soluissa, joiden joukossa hiilihydraattiketjujen sitoutumiskohta on tyypillinen glykoproteiineille ja proteiinikinaasien tunnistuskohta, joilla on spesifiset toiminnot (treoniiniproteiinit/seriinikinaasit) erottuvat) erottuvat) erottuvat) erottuvat).
Samoin Treonine on olennainen komponentti proteiineissa, kuten hammaskrilla, elastiini ja kollageeni, ja sillä on myös tärkeitä toimintoja hermostossa. Sitä käytetään elintarvikkeena ja ahdistuksen ja masennuksen fysiologisten tilojen "lieventäjänä".
[TOC]
Ominaisuudet
Treoniini kuuluu polaariseen aminohapporyhmään, jolla on R- tai sivuketjuryhmä, josta puuttuu positiivisia tai negatiivisia kuormia (ei -ladatut polaariset aminohapot).
R -ryhmän ominaisuudet on valmistettu erittäin liukoisella aminohapolla (hydrofiilinen tai hydrofiilinen), mikä pätee myös tämän ryhmän muihin jäseniin, kuten kysteiini, seriini, asparagiini ja glutamiinit.
Yhdessä tryptofaanin, fenyylialaniinin, isoleusiinin ja tyrosiinin kanssa Treonine on yksi viidestä aminohaksosta, jolla on sekä glukogeenisiä että ketogeenisiä toimintoja, koska sen aineenvaihdunnasta on merkityksellisiä välittäjiä, kuten pyruvaattia ja sukkinyyli-CoA: ta.
Tämän aminohapon likimääräinen molekyylipaino on 119 g/mol; Kuten monissa aminohapoissa ilman kuormaa, siinä on isoelektrinen piste noin 5.87 ja sen taajuus proteiinirakenteissa on lähellä 6%.
Jotkut kirjoittajat ryhmittelevät treoniinin yhdessä muiden "makean" maun aminohappojen kanssa, joista ovat esimerkiksi seriini, glysiini ja alaniini.
Rakenne
Α-aminohapolla, kuten treoniini, on yleinen rakenne, ts. Se on yleistä kaikille. Tämän erottuu hiiliatomin läsnäolosta, joka tunnetaan nimellä “a -hiili”, joka on kiraalinen ja johon on liitetty neljä tyyppiä molekyylejä tai erilaisia substituentteja.
Tällä hiilillä on yksi sen sidoksista vetyatomin kanssa, toisella R -ryhmällä, joka on ominainen jokaiselle aminohapolle, ja kaksi muuta ovat aminoheryhmät (NH2) ja karboksyyli (COOH), jotka ovat yleisiä kaikille Aminohapot.
Toniiniryhmässä R on hydroksyyliryhmä, jonka avulla se voi muodostaa vety silloja muiden molekyylien kanssa vesipitoisissa väliaineissa. Sen identiteetti voidaan määritellä alkoholiryhmäksi (etanoliksi, jolla on kaksi hiiliatomia), joka on menettänyt yhden hydrogeista liittyäkseen a (-Chah-Ch3) hiiliatomiin,.
Tämä ryhmä -OH voi toimia "siltana" tai unionin paikkana monille molekyyleille (tämä voidaan liittää esimerkiksi oligosakkaridiketjuihin glykoproteiinien muodostumisen aikana), joten se on yksi niistä, jotka ovat vastuussa muodostumisen muodostumisesta Modifioidut treonine -johdannaiset.
Tämän aminohapon biologisesti aktiivinen muoto on L-treoniini, ja juuri tämä osallistuu sekä proteiinirakenteiden muodostumiseen että erilaisiin aineenvaihduntaprosesseihin, joissa se toimii.
Funktiot
Aminohappoproteiinina treoniini on osa luonnon monien proteiinien rakennetta, missä sen merkitys ja varallisuus riippuvat sen proteiinin identiteetistä ja toiminnasta, johon se kuuluu.
Voi palvella sinua: heteroosi: eläinten parantaminen, kasveissa, ihmisessäProteiinien peptidisekvenssin muodostumisen rakenteellisten toimintojen lisäksi Treonine täyttää muut toiminnot sekä hermostossa että maksassa, missä se osallistuu rasvan aineenvaihduntaan ja estää sen kertymisen tässä elimessä tässä elimessä.
Treonine on osa sekvenssejä, jotka on tunnistettu entsyymeillä Serín/Treonina -kinaasit, jotka ovat vastuussa lukuisista proteiinifosforylaatioprosesseista, jotka ovat välttämättömiä toimintojen moninaisuuden ja solunsisäisen signalointitapahtuman säätelemiseksi.
Sitä käytetään myös joidenkin suoliston ja ruuansulatushäiriöiden hoitoon ja sen hyödyllisyyteen patologisten tilojen, kuten ahdistuksen ja masennuksen, vaimennuksessa on osoitettu.
L-treoniini on myös yksi aminohapoista, joita tarvitaan hiiren alkion kantasolujen pluripotentin tilan ylläpitämiseksi, tosiasia, joka ilmeisesti liittyy S-adenosyyli-metioniinin metaboliaan ja suoraan histonien metylaatiotapahtumiin, jotka ovat suoraan mukana geenien ilmentymisessä.
Teollisuudessa
Monien aminohappojen yhteinen ominaisuus on sen kyky reagoida muiden kemiallisten ryhmien, kuten aldehydien tai ketonien kanssa, monien yhdisteiden ominaisten "makujen" muodostumiseksi.
Näistä aminohapoista on treoniini, joka seriininä reagoi sakkaroosin kanssa TOS: n aikana.
Treonine on läsnä monissa luonnollisissa lääkkeissä ja myös monissa ravitsemuslisäaineiden formulaatioissa, jotka on määrätty aliravitsemuksen potilaille tai joilla on huonoja ruokavalioita tässä aminohapossa.
Toinen L-treoninen pahamaineisimmista toiminnoista, jotka ovat ajan myötä kasvaneet, on additiivinen keskittyneiden elintarvikkeiden valmistuksessa sikoihin ja siipikarjan tuotantoteollisuuteen.
L-treoniinia käytetään näillä toimialoilla elintarvikealisina huonoissa formulaatioissa proteiinin kannalta, koska tämä tarjoaa taloudellisia etuja ja lievittää raakaproteiinin puutteita, joita nämä maatilan eläimet kuluttavat.
Tämän aminohapon tuotantomuoto on normaalisti mikrobien käymis- ja maailmantuotantohahmot maatalouden tarkoituksiin vuodelle 2009 ylittivät 75 tonnia.
Biosynteesi
Treonine on yksi ihmisen yhdeksästä välttämättömästä aminohaposta, mikä tarkoittaa, että kehon solujen ei voida syntetisoida ja siksi, jotka on hankittava päivittäisen ruokavalion mukana toimitetuista eläin- tai kasvien alkuperästä olevista proteiineista, jotka toimitetaan päivittäisessä ruokavaliossa.
Kasvit, sienet ja bakteerit syntetisoivat treonineja samanlaisista reiteistä, joilla voi olla joitain eroja toistensa kanssa. Suurin osa näistä organismeista alkaa kuitenkin Aspartosta edeltäjänä, ei vain Treoninen, vaan myös menetelmille ja lysiinille.
Biosinteesin reitti mikrobissa
L-treoninen biosynteesireiti mikro-organismeissa, kuten bakteereissa. Lähtösubstraatti, kuten kommentoi, on aspartaatti, joka fosforyloi entsyymi ATP-riippuvainen quinasa-aspartaatti.
Tämä reaktio tuottaa metaboliitin L-asfaattfosfaatin (L-aspartil-P), joka toimii substraattina semiiadehydisen aspartyylientsyymidehydrogenaasille, joka katalysoi sen muuntamisen puoliksi riippuvaiseksi puoliksi riippuvaiseksi aspartyylisyyliksi.
Semiiardhaide-aspartyyliä voidaan käyttää sekä L-lisiinin biosynteesiin että L-treoninen biosynteesiin; Tässä tapauksessa molekyyliä käyttää Homoseriini-entsyymi NADPH-riippuvainen riippuvainen riippuvainen L-Homoserinan tuotannosta.
L-homoseriini fosforyloituu L-homoseriinifosfaattiin (L-Homoserina-P) homoseriini-ATP-riippuvaisella kinaasilla ja mainittu reaktiotuote puolestaan on synteettisen treoniinentsyymin substraatti, joka kykenee syntetisoimaan L-trinaania.
L-metioniini voidaan syntetisoida edellisessä vaiheessa tuotetusta L-homoseriinistä, joten se edustaa ”kilpailukykyistä” reittiä L-treoninen synteesiä varten.
Syntetisoitua L-treoniinia tällä tavalla voidaan käyttää proteiinisynteesiin tai sitä voidaan käyttää myös alavirtaan glysiinin ja L-leusiinin synteesiin, kaksi merkityksellistä aminohappoa myös proteiinin näkökulmasta.
Voi palvella sinua: evoluutioteoriatSäätö
On tärkeää korostaa, että kolme viidestä entsyymistä, jotka osallistuvat L-treoniinin biosynteesiin bakteereissa, säätelee reaktion tuote negatiivisella palautteella. Nämä ovat kinaasin aspartaatti, homoseriinidehydrogenaasi ja homoseriinikinaasi.
Lisäksi tämän biosynteettisen reitin säätely riippuu myös muiden siihen liittyvien biosynteettisten tuotteiden soluvaatimuksista, koska L-Lisiniinin, L-metioniinin, L-isoleusiinin ja glysiinin muodostuminen on riippuvainen tuotantoreitistä Lensi.
Heikkeneminen
Treonine voidaan hajottaa kahdella eri reittillä pyruvaatin tai sucninyyli-CoA: n tuottamiseksi. Jälkimmäinen on tärkein Troonine -katabolismin tuote ihmisillä.
Treonine -aineenvaihdunta tapahtuu pääasiassa maksassa, mutta haima, vaikkakin vähemmässä määrin, osallistuu myös tähän prosessiin. Tämä reitti alkaa aminohapon kuljetuksella maksasolujen plasmamembraanin läpi spesifisten kuljettajien avulla.
Pyruvate -tuotanto Treoninen
Trooninen muuntaminen pyruvaatiksi tapahtuu sen muutoksen ansiosta glysiiniksi, joka tapahtuu kahdessa katalyyttisessä vaiheessa, jotka alkavat 2-amino-3-cetobutiraatin muodostumisella trooninen ja entsyymi-trooniinidehydrogenaasin vaikutuksesta.
Ihmisessä tämä reitti edustaa vain 10–30% trooninen katabolismista, mutta sen merkitys on kuitenkin suhteessa organismiin, jota pidetään, koska esimerkiksi muissa nisäkkäissä tämä on paljon merkityksellisempi katabolisesti puhuminen.
Succinil-CoA -tuotanto Treoninasta
Kuten metioniini, Valina ja isoleusiini, Treoninen hiiliatomeja käytetään myös Succunil-CoA-tuotantoon. Tämä prosessi alkaa aminohapon muuntamalla a-ketterointikeskukseen, jota myöhemmin käytetään a-zo-tisoat-dehydrogenaasientsyymin substraattina propionil-CoA: n suorittamiseksi.
Trooniinin transmotionaasi katalysoi entsyymi-dehydrataasi, joka merkitsee vesimolekyylin (H2O) ja toisen ammonium-ionin (NH4+) menetystä (NH4+).
Propionyyli-CoA on karboksyloitu metyylimalonyyli-CoA: ssa kaksivaiheisella reaktiolla, joka vaatii bikarbonaattihiiliatomin (HCO3-) pääsyn. Tämä tuote toimii substraattina metyylimaloniil-CoA-mutasa-koentsyymi B12-riippuvaiselle, joka "epimeroi" molekyylin tuottamaan sukkinyyli-CoAA: ta.
Muut kataboliset tuotteet
Lisäksi treoninen hiilirunkoa voidaan käyttää katabolisesti asetyyli-CoA: n tuotantoon, jolla on myös tärkeitä vaikutuksia kehon solujen energian kannalta.
Tietyissä organismeissa Treonine toimii myös joidenkin biosynteettisten reittien, kuten esimerkiksi isoleusiinin, substraattina. Tässä tapauksessa viiden katalyyttisen vaiheen kautta treoninen katabolismista johdettu α-ecthobutiraatti voidaan suunnata isoleusiinin muodostumiseen.
Ruoat, joissa on runsaasti treonine
Vaikka suurimmalla osalla proteiinin runsaasta elintarvikkeesta on tietty prosenttiosuus kaikista aminohapoista, on määritetty, että munat, maidot, soija ja gelatiini ovat erityisen runsaasti trooniiniaminohapossa.
Treonine on myös eläinlihassa, kuten kana, sika, kani, lammas ja erityyppiset linnut. Kasvien alkuperän elintarvikkeissa sitä on runsaasti sipulissa, valkosipulissa, chardissa ja munakoisoissa.
Sitä löytyy myös riisistä, maissista, vehnäleseistä, palkokasvien jyvistä ja monista hedelmistä, kuten mansikoista, banaaneista, viinirypäleistä, ananasista, luumuista ja muista proteiineja, kuten pähkinöitä tai pistaasipähkinöitä.
Saannisi edut
Maailman maatalouden ja ruoan terveysjärjestön asiantuntijoiden komitean (joka, FAO) mukaan Treoninan päivittäinen vaatimus keskimääräiselle aikuiselle ihmiselle on noin 7 mg kilogrammaa ruumiinpainoa, joka on hankittava ruokavaliolla nautitusta ruoasta.
Voi palvella sinua: Punainen fenolista: Ominaisuudet, valmistelu, sovelluksetNämä luvut johtuvat kokeellisista tiedoista, jotka on saatu miesten ja naisten kanssa tehdyistä tutkimuksista, joissa tämä treoninen määrä riittää saamaan positiivisen typpitasapainon kehon soluissa.
Kuitenkin 6 kuukauden ja vuoden ikäisten lasten tutkimukset ovat kuitenkin osoittaneet, että näille L-treoninen vähimmäisvaatimukset ovat välillä 50–60 mg kilogrammaa päivässä päivässä.
Ravitsemuslisäaineiden tai lääkkeiden saannin tärkeimmistä eduista, joissa on erityisiä formulaatioita, joissa on runsaasti L-treoniinia, ovat sivuttaisen amyotrofisen skleroosin tai Lou Gehrig -taudin hoito.
Lisä treoninen tarjonta suosii ravinteiden imeytymistä suolistossa ja myötävaikuttaa myös maksatoimintojen parantamiseen. Se on myös tärkeää fosfaattiryhmien kuljettamiselle solujen kautta.
Puutoshäiriöt
Pienillä lapsilla Treonine -aineenvaihdunnassa on syntyneitä vikoja, jotka aiheuttavat kasvuviivettä ja muita siihen liittyviä aineenvaihduntahäiriöitä.
Tämän aminohapon puutteet on liitetty joihinkin lapsen painonnousun epäonnistumisiin muiden typen pidättämisen puuttumisen ja sen virtsan menetyksen puuttumisen lisäksi.
Ihmisillä, joille Treoninassa on huonoja ruokavalioita.
Viitteet
- Barret, G., & Elmore, D. (2004). Aminohapot ja peptidit. Cambridge: Cambridge University Press.
- Borgonha, S., Regan, m. M., Oi s. H., Condon, m., & Young, V. R -. (2002). Terveiden aikuisten treoniinitarpeet, jotka on derced 24 tunnin indikaattorilla aminohappotasapainotekniikka. American Journal of Clinical Nutrition, 75(4), 698-704.
- Bradford, H. (1931). Aminohappojen löytämisen historia. II. Katsaus aminohappoihin, jotka on kuvattu vuodesta 1931 alkuperäisten proteiinien komponentteina. Edistykset proteiinikemiassa, 81-171.
- Champe, P., & Harvey, R. (2003). Aminohapot aminohapot. Sisään Lippincottin kuvitetut arvostelut: biokemia (3. ed., pp. 1-12). Lippincott.
- De Lange, c. F. M., Gillis, a. M., & Simpson, G. J -. (2001). Threoniinin saannin vaikutus WHOE-vartaloproteiinien laskeutumiseen ja treoniinin käytökseen kasvavilla sialla, jota ruokitaan puhdistettuja ruokavalioita. Eläintieteiden lehti, 79, 3087-3095.
- Edelman, a., Blumenthal, D., & Krebs, ja. (1987). Seriini/treoniinikinaasiproteiini. Annu. Rev., 56, 567-613.
- Edsall, J. (1960). Aminohapot, proteiinit ja syöpäbiokemia (Vol. 241). Lontoo: Academic Press, Inc.
- Talo, j. D -d., BILL, B. N., & Brosnan, J. T. (2001). Threonine -aineenvaihdunta eristetyissä rotan hepatosyytteissä. American Journal of Physiology - endokrinologia ja aineenvaihdunta, 281, 1300-1307.
- Hudson, b. (1992). Ruokaproteiinien biokemia. Springer-Science+Business Media, B.V.
- Kaplan, M., & Flavin, M. (1965). Treoniini -biosynteesi. Sienien ja bakteerien polulla ja isomerointireaktion mekanismissa. Biologisen kemian lehti, 240(10), 3928-3933.
- Kidd, m., & Kerr, b. (1996). Siipikarjan l-treoniini: arvostelu. Sovellettu siipikarjatiede, Inc., 358-367.
- Pratt, E., Snyderman, S., Cheung, m., Norton, P., & Holt, ja. (1954). Normaalin lapsen treoniinivaatimus. Nutrition Journal, 10(56), 231-251.
- Rigo, j., & Senterre, J. (1980). Optimaalinen treoniinin saanti ennenaikaisesti, joka on syötetty suun tai parenteraaliseen ravitsemukseen. Parenteraalisen ja enteraalisen ravitsemuksen lehti, 4(1), 15-17.
- Shyh-chang, n., Locasale, j. W -., LyssSiotis, C. -Lla., Zheng, ja., Teo, r. JA., Ratanasirintrawoot, s.,... Cantley, L. C. (2013). Treoniinimetabolian vaikutus S-adensyylimeetioniiniin ja histonimetylaatioon. Tiede, 339, 222-226.
- Vickery, H. B -., & Schmidt, c. Lens. -Lla. (1931). Aminohappojen löytämisen historia. Kemialliset arvostelut, 9(2), 169-318.
- MD -verkko. (n.d -d.-A. Haettu 10. syyskuuta 2019, www.Webmd.com/-vitamiini/AI/AineasteMono-1083/treoniini
- Mato, e. H., & Pardee,. B -. (1958). Threoniinin biosynteesin säätely Escherichia colissa. Biokemian ja biofysiikan arkistot, 78(2), 416-432.
- Xunyan, x., Quinn, p., & Xiaoyuan, x. (2012). Tutkimusportti. Haettu 10. syyskuuta 2019, www.Tutkimussarja.Verkko/kuva/biosynteesi-l-l-treoniini-the-rway-Consists-of-fi-VE-entsymaattiset-askelmat_fig1_232320671

