Voltamperometria
- 4942
- 280
- Edgar VonRueden
 Voltamperometria on sähkökemiallinen menetelmä, joka mittaa elektrodin virtaa
Voltamperometria on sähkökemiallinen menetelmä, joka mittaa elektrodin virtaa Mikä on voltamperometria?
Se voltamperometria Se on elektroanalyyttinen tekniikka, joka määrittää kemiallisten tai analyyttejen tietoa käytetyn potentiaalin vaihtelulla syntyneistä sähkövirroista. Eli sovellettu potentiaalinen E (v) ja aika (t) ovat riippumattomia muuttujia; Kun taas virta (a), riippuvainen muuttuja.
Kemiallisten lajien tulisi yleensä olla sähköaktiivisia. Tämä tarkoittaa, että sen on hävitettävä (hapettuminen) tai voitettava (vähentää) elektroneja. Reaktion aloittamiseksi työelektrodin on annettava tarvittava potentiaali teoreettisesti Nernst -yhtälön avulla.
Tätä menetelmää käytetään laajasti epäorgaanisessa, biokemiassa ja fysikaalisessa kemiassa, etenkin muun muassa hapettumisen, vähentämisen tai adsorptioprosessien analysoimiseksi.
Kuinka voltamperometria toimii?
Voltamperometria kehitettiin vuoden 1922 Nobel Chemistry Nobel -palkinnon, Jaroslav Heyrovsky (1890-1967) keksinnön ansiosta. Siinä elohopean pudotuselektrodi (EGM) uusitaan ja polarisoituu jatkuvasti.
Tämän menetelmän analyyttiset puutteet tuolloin ratkaistiin muiden mikroelektrodien käytöllä ja suunnittelulla. Ne vaihtelevat suuresti materiaalista, hiilestä, jalo -metalleista, timantista ja polymeereistä, jopa sen suunnittelussa, levyissä, sylintereissä, levyissä; Ja lisäksi, tavalla, jolla he ovat vuorovaikutuksessa liuoksen kanssa: paikallaan tai pyörivät.
Kaikki nämä yksityiskohdat on tarkoitettu1-A. Tämä on verrannollinen analyytin pitoisuuteen ja puoleen tehosta E (E (E1/2) saavuttaa puolet tästä virrasta (i1/2) on tyypillinen lajeille.
Joten E: n arvojen määrittäminen1/2 Käyrässä, jossa E: n variaatiolla saatu virta on graafia, jota kutsutaan voltampperagrammi, Analyytin läsnäolo voidaan tunnistaa. Eli jokaisella analyyttillä, ottaen huomioon kokeen olosuhteet, on oma E1/2.
Voi palvella sinua: vastaavuuspisteVoltamperometrinen aalto
Voltamperometriassa työskentelemme monien kaavioiden kanssa. Ensimmäinen on käyrä E vs. T, jonka avulla voit seurata mahdollisia eroja, joita käytetään ajan funktiona.
Mutta samaan aikaan sähköpiiri tallentaa analyytin tuottamat C -arvot menettäessään tai vahvistavat elektroneja elektrodin läheisyydessä.
Koska elektrodi on polarisoitu, vähemmän analyytti voidaan levittää siihen liuoksen rintaan. Esimerkiksi, jos elektrodilla on positiivinen varaus, lajit X- Hänet houkuttelevat tähän ja johtaa hänet pelkästään sähköstaattiseen vetovoimaan.
Mutta x- ei ole yksin: ympäristössäsi on muita ioneja. Jotkut kationit m+ He voivat estää tiensä elektrodiin löytämällä se positiivisten maksujen "klustereihin"; ja myös anionit n- Ne voidaan varastaa elektrodin ympärillä ja estää x- Pääsen hänen luokseen.
Näiden fysikaalisten ilmiöiden summa aiheuttaa virran menettämisen, ja tämä havaitaan C VS: ssä. E ja sen muoto, joka on samanlainen kuin S, nimeltään Sigmoid -muoto. Tämä käyrä tunnetaan voltamperometrisena aaltona.
Soittimet
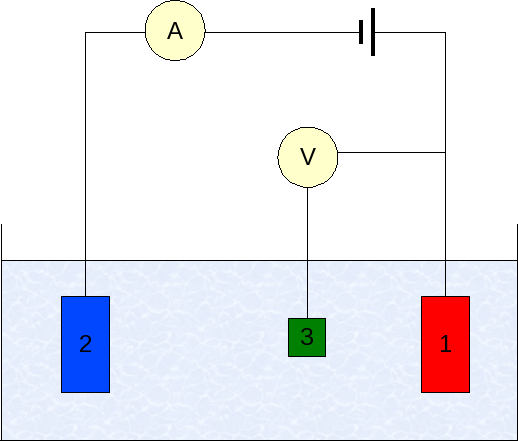 Voltamperometrian elektrodit. Lähde: Wikimedia Commons
Voltamperometrian elektrodit. Lähde: Wikimedia Commons Voltamperometrian instrumentointi vaihtelee analyytin, liuottimen, elektrodin tyypin mukaan. Mutta suurin osa heistä perustuu järjestelmään, joka koostuu kolmesta elektrodista: yksi työstä (1), apu (2) ja viite (3).
Pääselektrodi on Calomenanos -elektrodi (ECS). Tämä yhdessä työelektrodin kanssa mahdollistaa potentiaalieron ΔE, koska vertailuelektrodin potentiaali pysyy vakiona mittausten aikana.
Voi palvella sinua: Seleeni: historia, ominaisuudet, rakenne, hankkiminen, käyttöToisaalta apuelektrodi on vastuussa työelektrodille kulkevan kuorman ohjaamisesta, jotta se ylläpitää hyväksyttäviä arvoja. Riippumaton muuttuja, sovellettu potentiaaliero, on se, joka saadaan työelektrodien potentiaalien ja referenssien summalla.
Voltamperometrian tyypit
Artikkelin kuvassa esitetään kuvaaja. t, jota kutsutaan myös potentiaaliseksi lineaariseen skannaus voltamperometriaan.
Voidaan nähdä, että ajan myötä potentiaali kasvaa. Tämä pyyhkäisy puolestaan tuottaa vastauskäyrän tai voltamperaogrammi C vs. E, jonka muoto on sigmoidi. Tulee kohta, jossa riippumatta siitä, miten se kasvaa, virtaa ei kasvata.
Tästä kaaviosta voidaan päätellä muun tyyppisiä voltamperometriaa modifioimalla potentiaalista aaltoa. t äkillisillä potentiaalisilla pulssilla tiettyjen kuvioiden jälkeen. Jokainen malli liittyy tyyppiseen voltamperometriaan ja kattaa oman kokeellisen teorian ja olosuhteet.
Pulssi voltamperometria
Tämän tyyppisessä voltamperometriassa voit analysoida kahden tai useamman analyytin seoksia, joiden E e1/2 ovat hyvin lähellä toisiaan.
Siten analyytti E: n kanssa1/2 0.04V voidaan tunnistaa toisen seurassa E: n kanssa1/2 0.05 V. Kun taas lineaarisessa skannauksessa voltamperometriaa eron on oltava suurempi kuin 0.2V.
Siksi herkkyyttä ja alhaisempia havaitsemisrajoja on suurempi; toisin sanoen analyyttit voidaan määrittää erittäin alhaisina pitoisuuksilla.
Mahdollisilla aaltoilla voi olla samanlaiset kuviot kuin portaat, kaltevat portaat ja kolmiot. Jälkimmäinen vastaa syklistä voltamperometriaa (CV).
Voi palvella sinua: rajoittaminen ja liiallinen reagenssiCV: ssä potentiaali ja sovelletaan tietyssä mielessä positiivinen tai negatiivinen ja sitten tietyllä E: n arvolla kerrallaan sama potentiaali, mutta päinvastoin. Tutkiessaan syntyneitä voltampeogrammeja, maksimit paljastavat välittäjien läsnäolon kemiallisessa reaktiossa.
Redisolution Voltamperometria
Tämä voi olla anodista tai katodista tyyppiä. Se koostuu analyytin elektrodepositiosta elohopeaelektrodilla. Jos analyytti on metalli -ioni (kuten CD2+), muodostuu amalgaami; Ja jos se on anioni (kuten Moo42-), liukenematon elohopeasuola.
Sitten sovelletaan potentiaalisia pulsseja ElectrodePos -lajien pitoisuuden ja identiteetin määrittämiseksi. Siten amalgaami on redisuelve, aivan kuten elohopeasuolat.
Voltamperometriasovellukset
- Anodista Redisolution Voltamperometriaa.
- Se mahdollistaa redox- tai adsorptioprosessien kinetiikka.
- Sen teoreettinen perusta on palvellut biosensorien valmistuksessa. Näiden kanssa biologisten molekyylien, proteiinien, rasvojen, sokerien jne. Läsnäolo ja konsentraatio voidaan määrittää.
- Lopuksi se havaitsee välittäjien osallistumisen reaktiomekanismeihin.
Viitteet
- González m. (2010). Voltamperometria. Palautettu: kemia.Laguia2000.com
- Kemia ja tiede (2011). Voltamperometria. Haettu: Thequimica Andlaciencia.Blogin.com
- Quiroga a. (2017). Syklinen voltammetria. Palautettu: Chem.Librettexts.org
- Samuel P. Kouves (s.F.-A. Voltammetriset tekniikat. [PDF]. Tufts -yliopisto. Toipunut: Brown.Edu
- Päivä r. & Underwood a. Kvantitatiivinen analyyttinen kemia (Viides ed.-A. Pearson Prentice Hall.

