Rikkioksidi
- 1828
- 316
- Dr. Travis Reichert
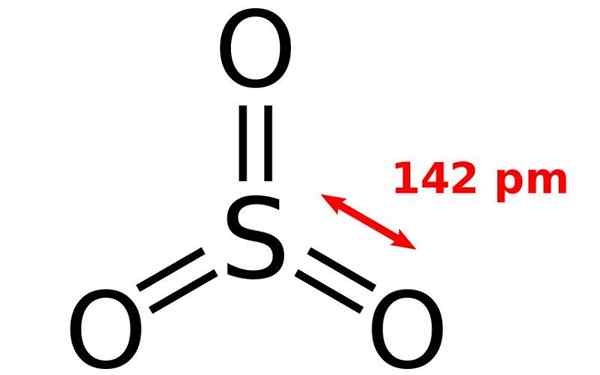
 Rikkioksidimolekyylin kemiallinen rakenne. Lähde: Joel Holdsworth, Wikimedia Commons
Rikkioksidimolekyylin kemiallinen rakenne. Lähde: Joel Holdsworth, Wikimedia Commons Mikä on rikosoksidi?
Hän rikkioksidi (VI), joka tunnetaan myös nimellä rikki- tai rikkihappoanhydriditrioksidi, on kaavan kemiallinen yhdiste3, Se, että normaalissa olosuhteissa se on väritön ja kuitumainen kiinteä kiinteä, ja 25 ° C: ssa ja 1 atm on voimakas saastuttava aine, joka vastaa happaan sateesta.
Rikkitrioksidia tuotetaan rikkihapen hapetuksella.
Tähän asti ainoa puhdas rikkitrioksidin valmistus kaasuista, jotka sisältävät3 Laimennettu, se on ollut prosessi pilottihaitoksen mittakaavassa, joka merkitsee kryoskooppista kondensaatiota.
Tavallinen menettely merkitsee sen sijaan öljyn tislausta. Öljyn tislausta varten vaadittava lämpö toimitetaan helpommin kuumalla kosketuskaasulla liittyvästä rikkihappokasvista.
Se voidaan valmistaa laboratoriossa lämmittämällä tupakointia rikkihappoa ja keräämällä sublimoitua jäähdytetyllä vastaanottimella. Jos höyry tiivistetään yli 27 ° C, gamman muoto saadaan nesteeksi.
Jos höyry tiivistetään alle 27 ° C. 3 muotoa voidaan erottaa murto -tislaamalla.
Fossiilisten polttoaineiden polttaminen on syy sen esiintymiseen ilmakehässä, tämä on tärkein antropogeeninen syy.
Rikkioksidin fysikaaliset ja kemialliset ominaisuudet
- Rikkitrioksidi on muotoiltu kuin valkoiset neulat, joista tulee savua ilmassa. Kohtaat usein estäjiä polymeroinnin välttämiseksi.
Voi palvella sinua: Renio: Löytö, ominaisuudet, rakenne, käyttötarkoitukset- Sen molekyylipaino on 80 066 g/mol, sen tiheys on 1,92 g/cm³ g/ml ja fuusio- ja kiehumispisteet ovat vastaavasti 16,8 ° C ja 44,7 ° C.
- Yhdiste yhdistetään veteen räjähtävällä voimalla, joka muodostaa rikkihappoa sen happamuuden vuoksi. Carboniza -rikkitrioksidi -orgaaniset aineet.
- Rikkitrioksidi absorboi kosteutta nopeasti, säteilemällä tiheitä valkoisia höyryjä. Rikkihappostrioksidiliuoksia kutsutaan Tupakoinnin rikkihapoksi tai öljyksi.
- Rikkitrioksidireaktio ja happea diffluoridi on erittäin voimakas ja räjähdykset tuotetaan, jos reaktio suoritetaan liuottimen puuttuessa.
- Ylimääräinen rikkitrioksidireaktio tetrafluorietyleenin kanssa aiheuttaa karbonyylifluoridin ja rikkidioksidin räjähtävää hajoamista.
- Vedetön perkloorihapon reaktio rikkitrioksidin kanssa on väkivaltainen ja siihen liittyy huomattavan lämmön kehitys. Nestemäinen rikkitrioksidi reagoi väkivaltaisesti nitriilikloridin kanssa, jopa 75 ° C.
- Rikkitrioksidireaktio ja lyijyoksidi aiheuttaa valkoisen luminesenssin. Jodin, pyridiinin, rikki- ja formamiditrioksidin yhdistelmä kehitti kaasun paineessa useiden kuukausien jälkeen.
Tämä johtuu rikkihapon, ulkoisen veden tai vedyn formamidin kuivumisesta hitaasta muodostumisesta.
Riskejä
Rikkitrioksidi on stabiiliyhdiste, joka on yhteensopimaton orgaanisten materiaalien, hienoksi jauhemetallien, emäksen, veden, syanidien ja monenlaisten muiden kemikaalien kanssa.
Aine on vahva hapettiminen ja reagoi väkivaltaisesti palavien materiaalien ja järjestäjien ja orgaanisten yhdisteiden kanssa, jotka aiheuttavat tulipalon ja räjähdysvaaran.
Voi palvella sinua: natriumoksalaatti (NA2C2O4): rakenne, ominaisuudet, käytöt, riskitReagoi väkivaltaisesti märän veden ja ilman kanssa rikkihapon tuottamiseksi. Veden liuos on vahva happo, se reagoi väkivaltaisesti emäksien ja syövyttävien metallien kanssa, muodostaen syttyvän / räjähtävän kaasun.
Yhdiste on syövyttävä metalleille ja kudoksille. Aiheuttaa silmien ja ihon palovammoja. Nieleminen aiheuttaa vakavia palovammoja suussa, ruokatorvessa ja vatsassa. Höyry on erittäin myrkyllistä hengittämällä.
Silmäkontaktin tapauksessa sinun on tarkistettava, käytetäänkö piilolinssejä ja poista ne välittömästi. Silmät tulee huuhdella juoksevalla vedellä vähintään 15 minuutin ajan pitämällä silmäluomet auki. Kylmää vettä voidaan käyttää levittämättä silmävoidetta.
Jos kemikaali joutuu kosketuksiin vaatteiden kanssa, pidä se mahdollisimman nopeasti, suojaamalla omia käsiä ja vartaloaan. Aseta uhri turvasuihkun alle.
Jos kemikaali kertyy uhrin paljaaseen ihoon, kuten kädet, juoksevalla vedellä ja ei -kiireellisellä saippualla saastunut iho pestään pehmeästi ja varovasti. Kylmää vettä voidaan käyttää. Jos ärsytys jatkuu, hakea lääkärinhoitoa. Pese saastuneita vaatteita ennen kuin käytät sitä uudelleen.
Hengityksen tapauksessa uhrin tulisi antaa seistä hyvin tuuletetulla alueella. Jos hengitys on vakava, uhri on evakuoitava turvalliselle alueelle mahdollisimman pian. Löysät tiukka vaatteet, kuten paita kaula, vyöt tai solmio.
Jos uhria on vaikea hengittää, happi on annettava. Jos uhri ei hengitä, suuhun suuhun elvytys tehdään. Aina ottaen huomioon, että se voi olla vaarallista henkilölle, joka tarjoaa apua suuhun suuhun, kun hengitetty materiaali on myrkyllistä, tarttuvaa tai syövyttävää.
Se voi palvella sinua: Aivolisäkkeen happo (H3PO2): Ominaisuudet, käytöt ja reagenssitKaikissa tapauksissa olisi pyydettävä välitöntä lääketieteellistä hoitoa.
Toisaalta rikkioksidien aiheuttama ilman pilaantuminen on tärkeä ympäristöongelma, ja miljoonia tonnia rikkidioksidia ja trioksidia lähetetään ilmakehään vuosittain. Nämä yhdisteet ovat haitallisia kasvien ja eläinten elämälle sekä monille rakennusmateriaaleille.
Toinen suuri harkittava ongelma on hapan sade. Molemmat rikkioksidit liukenevat ilmakehän vesipisaroihin happoliuoksien muodostamiseksi, jotka voivat olla erittäin haitallisia, kun ne putoavat sateen muodossa.
Hapan sade voi vahingoittaa metsiä ja aiheuttaa kalojen kuoleman monissa järvissä. Se on myös syövyttävää metalleille, kalkkikiville ja muille materiaaleille. Mahdolliset ratkaisut tähän ongelmaan ovat kalliita johtuen vaikeuksista poistaa hiilen ja öljyn rikki ennen niiden polttamista.
Sovellukset
- Rikkitrioksidi on välttämätön reagenssi sulfonaatioreaktioissa. Nämä prosessit tarjoavat pesuaineita, väriaineita ja lääketuotteita. Se syntyy in situ rikkihaposta tai sitä käytetään tupakoinnin rikkihappoliuoksena.
- Sen desinfiointiaineet ovat vastuussa vuosisatojen ajan viinikuutioiden desinfioinnista, rikin polttamiseen niiden sisällä.
Viitteet
- Trioksidirikki. Toipunut EBI: stä.Ac.Yhdistynyt kuningaskunta
- Turvallisuustietolomake rikkitrioksidi. Sciencelabista toipunut.com

