50 esimerkkiä hapoista ja emäksistä

- 4323
- 1036
- Shawn Stanton II
Siellä on satoja Esimerkkejä hapoista ja emäksistä Se löytyy kaikista kemian haaroista, mutta kokonaisuutena ne on jaettu kahteen suureen perheeseen: epäorgaaninen ja orgaaninen. Inorgaanihappot tunnetaan yleensä mineraalihapona, jolle on ominaista erityisen vahva orgaanisiin verrattuna.
Hapot ja emäkset ymmärretään aineiksi, joilla on vastaavasti surkeat maut tai saponáceos. Molemmat ovat syövyttäviä, vaikka sanaa 'kaustinen' käytetään yleensä vahvoihin emäksiin. Yhteenvetotilit: Ne polttavat ja ajavat ihoa, jos ne koskettavat sitä. Sen ominaisuudet liuotinmediassa ovat suunnitelleet määritelmien sarjan koko historian ajan.
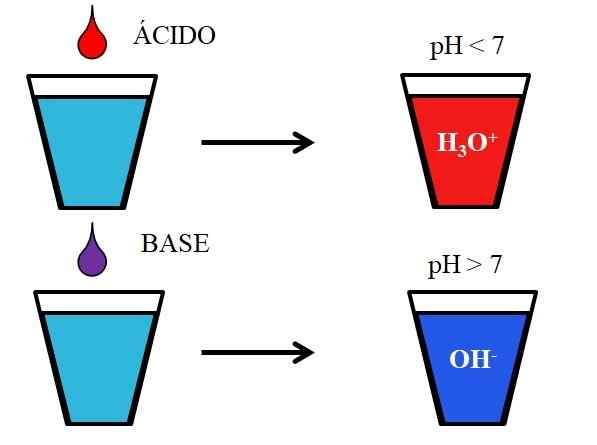 Happojen ja emästen käyttäytyminen veteen liuennessa. Lähde: Gabriel Bolívar.
Happojen ja emästen käyttäytyminen veteen liuennessa. Lähde: Gabriel Bolívar. Alempi kuva näyttää happojen ja emästen yleisen käyttäytymisen, kun ne lisätään tai liuenee vedellä olevaan lasiin. Hapot tuottavat liuoksia, joiden pH -arvot ovat alle 7, hydroonio -ionien vuoksi, H3JOMPIKUMPI+; Vaikka emäkset tuottavat liuoksia, joiden pH on yli 7 hydroksyyli -ionien (tai oksidrilin) vuoksi, OH-.
Jos lisäämme suolahappoa HCl (punainen pudotus) lasiin, siellä on H -ioneja3JOMPIKUMPI+ ja cl- kosteutettu. Toisaalta, jos toistamme kokeen natriumhydroksidilla, NaOH: lla (violetti pudotus), meillä on OH -ionit- ja na NA+.
[TOC]
Määritelmät

Happojen ja emästen yhä enemmän tutkitut ja ymmärretyt ominaisuudet asettavat useamman kuin yhden määritelmän näille kemiallisille yhdisteille. Näistä määritelmistä meillä on Arrhenius, Bronsted-Lowry ja lopulta Lewisin määritelmät. Ennen kuin viitataan esimerkkeihin, on tarpeen saada tämä selvä.
Arrhenius
Arrheniuksen mukaan hapot ja emäkset ovat niitä, jotka liuenneet veteen tuottavat H -ioneja3JOMPIKUMPI+ tai tai oh-, vastaavasti. Eli kuva edustaa jo tätä määritelmää. Se sinänsä kuitenkin halveksii joitain liian heikkoja hapoja tai emäksiä sellaisten ionien tuottamiseksi. Täällä Bronsted-Lowryn määritelmä tulee.
Voi palvella sinua: hapot: ominaisuudet ja esimerkitBronsted-matala
Bronsted-matalat hapot ovat niitä, jotka voivat luovuttaa ionit H+, Ja tukikohdat ovat ne, jotka hyväksyvät nämä H+. Jos happo lahjoittaa erittäin helposti+, Se tarkoittaa, että se on vahva happo. Sama pätee tukikohtiin, mutta hyväksyy H+.
Siksi meillä on vahvat tai heikot hapot ja emäkset, ja niiden voimat mitataan eri liuottimissa; etenkin vedessä, joista tunnettuja pH -yksiköitä on perustettu (0–14).
Siksi vahva happo luovuttaa kokonaan H: n+ veteen tyypin reaktiossa:
Ha + h2O => a- + H3JOMPIKUMPI+
Minne- Se on HA: n konjugoitu pohja. Täältä tulee siksi h3JOMPIKUMPI+ läsnä lasissa happoliuoksella.
Samaan aikaan heikko B -pohja suojaa vettä saadakseen vastaavan H: n+-
B + h2Tai Hb + OH-
Missä HB on b: n konjugoitu happo. Näin on ammoniakki, NH3-
Nh3 + H2Tai NH4+ + vai niin-
Erittäin vahva pohja voi suoraan lahjoittaa OH -ionit- Ei tarvitse reagoida veden kanssa; Kuten NaOH: n kanssa.
Lewis
Lopuksi Lewis -hapot ovat niitä, jotka voittavat tai hyväksyvät elektroneja, ja Lewisin emäkset ovat ne, jotka luovuttavat tai menettävät elektroneja.
Esimerkiksi Bronsted-Lowry NH -pohja3 Se on myös Lewis -emäs, koska typpiatomi hyväksyy h: n+ Lahjoittamalla tämän heidän ilmaisten elektronien parin (H3N: h+-A. Siksi kolme määritelmää eivät ole eri mieltä keskenään, mutta ne kietoutuvat ja auttavat tutkimaan happamuutta ja emäksisyyttä laajemmassa kemiallisten yhdisteiden spektrissä.
Voi palvella sinua: Nikkeli: Historia, ominaisuudet, rakenne, käyttö, riskitEsimerkkejä hapoista
Määritelmien selventämisen mukaan jäljempänä mainitaan happosarja vastaavilla kaavoillaan ja nimillä:
-HF: Fluorahappo
-HBR: Bromhydric -happo
-Hei: Yodhydric -happo
-H2S: Sulfhydric -happo
-H2SE: Seleenhydric -happo
-H2TE: Telurhydric -happo
Nämä ovat binaarihappoja, joita kutsutaan myös hydraseidiksi, jotka kuuluvat edellä mainittuun suolahappoon, HCl.
-Hno3: typpihappo
-Hno2: Typpihappo
-HNO: hyponitroosihappo
-H2Yhteistyö3: Hiilihappo
-H2Yhteistyö2: CarbonosO -happo, joka tosiasiallisesti tunnetaan enemmän muurahaishapolla, HCOOH, kaikkien yksinkertaisin orgaaninen happo
-H3Poikki4: fosforihappo
-H3Poikki3 tai h2[HPO3]: fosforihappo, H-P-sidos
-H3Poikki2 tai h [h2Poikki2]: hypofosfäärinen happo, kahdella H-P-sidoksella
-H2Sw4: rikkihappo
-H2Sw3: Rikkihappo
-H2S2JOMPIKUMPI7: disulfuriinihappo
-Hio4: periódiinihappo
-Hio3: Yodiumihappo
-Hio2: jodoosihappo
-Hio: Hypoyodosohappo
-H2Kro4: kromihappo
-Hmno4: Mangaanihappo
-CH3COOH: etikkahappo (etikka)
-CH3Sw3H: Metanosulfonihappo
Kaikki nämä hapot, lukuun ottamatta muurahaisia ja kaksi viimeistä, tunnetaan oksácido- tai ternaarihapona.
Muut:
-ALCL3: alumiinikloridi
-FECL3: ferrikloridi
-Bf3: Boro Trifluoruro
-Metallikationit liuotettuna veteen
-Karbokaatiot
-H (CHByksitoistaClyksitoista): Superhappo Carborano
- FSO3H: Fluorosulfonihappo
- HSBF6: Fluorantimonihappo
- FSO3H · SBF5: Taikahappo
Neljä viimeistä esimerkkiä muodostavat pelottavia superhappoja; yhdisteet, jotka kykenevät hajottamaan melkein mitä tahansa materiaalia tuskin koskettamalla sitä. Alcl3 Se on esimerkki Lewis -happosta, koska alumiinimetallikeskus pystyy hyväksymään elektronit elektronisen puutteensa vuoksi (se ei täytä Valencia Octet).
Voi palvella sinua: Elohopeahydroksidi: rakenne, ominaisuudet, käytöt, riskitEsimerkkejä tukikohdista
Epäorgaanisista emäksistä meillä on metallihydroksidit, kuten natriumhydroksidi, ja joitain molekyylihydurnit, kuten jo mainittu ammoniakki. Tässä on muita esimerkkejä emäksistä:
-KOH: Kaliumhydroksidi
-Lioh: litiumhydroksidi
-RBOH: Rubidio -hydroksidi
-CSOH: Cesiumhydroksidi
-FROH: Francio -hydroksidi
-Ole (Voi)2: Beryl -hydroksidi
-Mg (OH)2: Magnesiumhydroksidi
-CA (OH)2: kalsiumhydroksidi
-SR (OH)2: Strontiumhydroksidi
-Ba (OH)2: bariumhydroksidi
-Ra (OH)2: radiohydroksidi
-Usko (Voi)2: rautahydroksidi
-Usko (Voi)3: rautahydroksidi
-Al (OH)3: alumiinihydroksidi
-PB (OH)4: Plúmbic -hydroksidi
-Zn (OH)2: sinkkihydroksidi
-CD (OH)2: kadmiumhydroksidi
-Cu (OH)2: Kupric -hydroksidi
-Ti (OH)4: Titanic -hydroksidi
-PHE3: fosfiini
-Tuhka3: Arsina
-Nanh2: natrium amiduro
- C5H5N: Pyridiini
-(CH3) N: trimetyyliamiini
- C6H5Nh2: Fenyyliamiini tai aniliini
-NAH: Natriumhydridi
-KH: Kaliumhydridi
-Carbanions
-Li3N: Litiumnitridi
-Alkoholisarja
-[(CH3-A2CH]2NLI: litiumin diisopropilamidi
-Diedinilbentseenianioni: c6H4C42- (toistaiseksi tunnettu vahvin perusta)
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Naomi Hennah. (10. lokakuuta 2018). Kuinka opettaa happoja, emäksiä ja suoloja. Palautettu: Edu.RSC.org
- Helmestine, Anne Marie, PH.D -d. (31. elokuuta 2019). Yleisten happojen ja emäksen kaavat. Toipunut: Admingco.com
- David Wood. (2019). Vertaa yleisiä happoja ja emäksiä. Opiskelu. Toipunut: Opiskelu.com
- Ross Pomeroy. (23. elokuuta 2013). Maailman vahvin happo: kuten tuli ja jää. Toipunut: RealClearScience.com
- Wikipedia. (2019). Dietynyylibentseeni -dianion. Haettu: vuonna.Wikipedia.org
- « Halkaisijaltaan symbolit ja kaavat, miten se otetaan, kehä
- Ekofysiologia Mitä tutkimuksia ja sovelluksia eläimissä ja vihanneksissa »

