Molaarinen absorboiva
- 3017
- 740
- Kelly Kilback
Mikä on molaarinen absorbointi?
Se Molaarinen absorboiva Se on kemiallinen ominaisuus, joka osoittaa, kuinka paljon valoa voi absorboida lajin liuoksessa. Eli se on yksikkö, joka mittaa liuoksen kyvyn absorboida valoa.
Koska valo koostuu fotoneista, joilla on energiaa (tai aallonpituuksia), lajista tai sekoitetuista seoksista riippuen fotoni voidaan absorboida suuremmassa määrin kuin toinen. Tarkoittaa, että valo absorboituu tietyillä aineen ominaisilla aallonpituuksilla.
Siten moolisen absorbaation arvo on suoraan verrannollinen valon imeytymisasteeseen tiettyyn aallonpituuteen. Jos laji absorboi punaisen valon, sen absorboiva arvo on alhainen. Jos punainen valo on voimakas absorptio, absorboitumisella on suuri arvo.
Laji, joka imee punaisen valon, heijastaa vihreää väriä. Jos vihreä väri on erittäin voimakas ja tumma, se tarkoittaa, että punaisen valon imeytyminen on voimakas.
Jotkut vihreät sävyt voivat kuitenkin johtua keltaisten ja sinisten eri alueiden reflekseistä, jotka sekoitetaan ja pidetään turkoosi vihreänä, smaragdina, lasina jne.
Molaarinen absorboiva yhtälö
Molaarinen absorbaatio on vakio määritelty Lambert-Beerin lain matemaattisessa ilmaisussa, ja yksinkertaisesti huomauttaa, kuinka paljon valo absorboi kemialliset lajit tai seokset. Yhtälö on:
A = εbc
Jos A on liuoksen absorbanssi valittuun λ -aallonpituuteen, B on solun pituus, jossa analysoitava näyte sisältyy, ja siksi etäisyys, että valo kulkee liuoksen sisällä, C on C, on absorboivien lajien pitoisuus ja ε, molaari absorboiva.
Se voi palvella sinua: AlquinosAnnetaan λ, joka ilmaistaan nanometreinä, ε: n arvo pysyy vakiona. Mutta muuttamalla λ: n arvoja, ts. Mittaamalla absorbansseja muiden energioiden valojen kanssa, ε muuttuu, saavuttaen minimi- tai maksimiarvon.
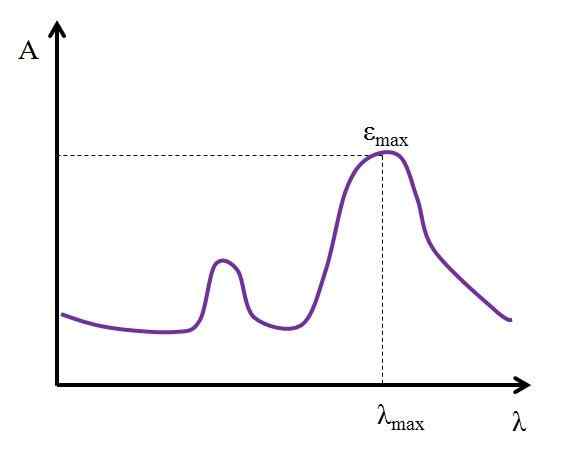
Jos sen maksimiarvo tunnetaan, εMax, Se määritetään samaan aikaan λMax. Eli valo, joka imeytyy lajeihin eniten:
 Kaavio, jossa esitetään kemiallisten lajien suurimman valon imeytymisarvot. Lähde: Gabriel Bolívar
Kaavio, jossa esitetään kemiallisten lajien suurimman valon imeytymisarvot. Lähde: Gabriel Bolívar Yksiköt
Jotta voimme tietää ε: n yksiköt, meidän on tiedettävä, että absorbanssit ovat mitattomia arvoja, ja siksi B- ja C -yksiköiden kertominen on kumottava.
Imettävien lajien pitoisuus voidaan ekspressoida joko g/l tai mol/l, ja B ilmenee yleensä CM: ssä tai M: ssä (koska valonsäteen ylittävän solun pituus). Molaarisuus on yhtä suuri kuin mol/l, joten C ekspressoituu myös m.
Siten B- ja C -yksiköiden kertominen saadaan: M ∙ cm. Yksiköt, jotka ε: n on jätettävä A: n arvo, ovat ne, jotka moninkertaisesti.
Selvität u, sinut yksinkertaisesti saadaan m-1∙ cm-1, joka voidaan kirjoittaa myös: l ∙ mol-1∙ cm-1.
Itse asiassa käytä m -yksiköitä-1∙ cm-1 tai l ∙ mol-1∙ cm-1 nopeuttaa laskelmia molaarisen absorbaation määrittämiseksi. Se ilmaistaan kuitenkin yleensä myös M -yksiköillä2/mol tai cm2/mol.
Näillä yksiköillä ilmaistuna joitain muuntotekijöitä on käytettävä B- ja C -yksiköiden modifiointiin.
Kuinka laskea molaarinen imevyys?
Suoran selvitys
Molaarinen imeytyminen voidaan laskea suoraan sen puhdistamisella edellisessä yhtälössä:
Voi palvella sinua: hapot ja emäkset jokapäiväisessä elämässä: reaktiot, käytöt, esimerkitε = a/bc
Jos absorboivien lajien pitoisuus tunnetaan, solun pituus ja aallonpituudella saatu absorbanssi voidaan laskea ε. Tämä laskentatapa tuottaa kuitenkin saavuttamattoman ja epäluotettavan arvon.
Graafinen menetelmä
Jos Lambert-Beerin lain yhtälö havaitaan huolellisesti, huomaa, että se muistuttaa viivan yhtälöä (y = ax+b).
Tämä tarkoittaa, että jos akselin arvot ovat graafisia. Siten se olisi y, x olisi C, ja se vastaa εb: tä.
Siksi linjakaavio, ottavat vain kaksi pistettä kaltevuuden määrittämiseksi, ts. Kun tämä on tehty, ja solun pituus B, on helppo puhdistaa ε.
Toisin kuin suora puhdistus, Graph Vs. C antaa sinun keskimäärin absorbanssimittaukset ja vähentää kokeellista virhettä, ja myös yhden pisteen kautta ne voivat kulkea äärettömän suoraan, joten suora puhdistuma ei ole käytännöllistä.
Myös kokeelliset virheet voivat tehdä viivan, joka ei läpäise kahden, kolmen tai useamman pisteen läpi, joten käytetään tosiasiallisesti vähimmäisnimenetelmän soveltamisen jälkeen (toiminto, joka on jo sisällytetty laskimiin).
Kaikki tämä olettaa korkean lineaarisuuden ja siksi Lamber-Beerin lain noudattamista.
Ratkaisut
Harjoitus 1
On tiedossa, että orgaanisen yhdisteen liuos, jonka konsentraatio on 0.008739 m esitteli absorbanssin 0.6346, mitattuna λ = 500 nm: llä ja solulla 0.5 cm pitkä. Laske, mikä on kompleksin molaarinen absorbointi mainitulle aallonpituudelle.
Voi palvella sinua: Nikkeli: Historia, ominaisuudet, rakenne, käyttö, riskitNäistä tiedoista se voidaan tyhjentää suoraan ε:
ε = 0.6346/(0.5 cm) (0.008739 m)
145.23 m-1∙ cm-1
Harjoitus 2
Seuraavat absorbanssit mitattuna metallikompleksin eri pitoisuuksilla aallonpituudella 460 nm ja 1 cm: n pituus: Pituus: pituus:
A: 0.03010 0.1033 0.1584 0.3961 0.8093
C: 1.8 ∙ 10-5 6 ∙ 10-5 9.2 ∙ 10-5 2.3 ∙ 10-4 5.6 ∙ 10-4
Laske kompleksin molaarinen kyvyttömyys.
On yhteensä viisi pistettä. Ε laskemiseksi on tarpeen piirtää ne asettamalla A -akselin arvot. Kun tämä on tehty, vähimmäisruutujen viiva määritetään, ja yhtälöllä se voidaan määrittää ε.
Tässä tapauksessa pisteitä kuvaavat ja piirsivät viivan määrityskertoimella r2 0.9905, kaltevuus on yhtä suuri kuin 7 ∙ 10-4, eli εb = 7 ∙ 10-4.
Siksi b = 1 cm, ε on 1428,57 m-1.cm-1 (1/7 ∙ 10-4-A.
Viitteet
- Molaarinen vaimennuskerroin. Haettu jstk.Wikipedia.org
- Tiedekoru. Molaarinen imeytymis. Sciencestruck.com
- Kolorimetrinen analyysi (oluen laki tai spektrofotometrinen analyysi). Chem.UCLA.Edu

