Ammoniumasetaatirakenne, ominaisuudet, käytöt ja riskit

- 3687
- 1045
- Ronald Reilly
Hän Ammoniumasetaatti Se on epäorgaaninen suola, jonka kemiallinen kaava on NH4CH3Haittaa. Se johtuu etikkahapon seoksesta, joka on läsnä kaupallisessa etikassa 5%: n pitoisuuteen ja ammoniakkiin. Molemmilla aloitusaineilla on ominaisia hajuja, joten on mahdollista saada käsitys siitä, miksi tämä suola haisee etikka-Ammoniasta.
Tämän suolan korostus ei kuitenkaan ole sen haju, vaan sen matala sulamispiste. Se on niin alhainen, että missä tahansa laboratoriossa se voitaisiin saada nestemäisessä versiossaan, jossa ionit virtaavat vapaasti sähkökuormien kuljettamiseen.
 Ammoniumasetaattikiteitä. Lähde: Vidak [julkinen verkkotunnus].
Ammoniumasetaattikiteitä. Lähde: Vidak [julkinen verkkotunnus]. Toisaalta ammoniumasetaatti on herkullinen; ts. imeä vettä tai ympäristön kosteutta, kunnes se on täysin liuennut. Siksi, vaikka vedettömässä tilassa heidän kiteet ovat valkoisia, ne muuttuvat nopeasti kirkkaiksi (kuten ylemmän kuvan dekantterilasiin).
Koska se on vakaa ammoniakin lähde, sitä on manipuloitava siten, että sen höyryjen hengittäminen minimoidaan. Mutta tästä negatiivisesta ominaisuudesta huolimatta NH4CH3COOH on hyödyllinen puskuriliuosten valmistuksessa, jotka ruoan säilyttäminen, kun taas se on komponentti tiettyjä liuotinproteiinien uuttolaitteita.
[TOC]
Ammoniumasetaatirakenne
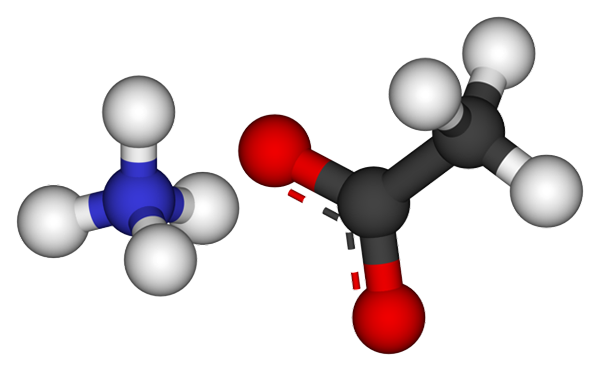 Ammoniumasetaatti -ionit. Lähde: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Ammoniumasetaatti -ionit. Lähde: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Yläkuva näyttää ionit, jotka muodostavat ammoniumasetaatin pallo- ja baarimallissa. Vasemmalla puolella on tetraedrinen geometrian kationi, NH4+, Oikealla ollessasi molekyylianioni, jossa kaksi purettua elektronia kahden happiatomin välillä, CH3Kujertaa- (Pistetty viiva punaisten pallojen välillä).
Siten molemmat ionit, NH4+ ja ch3Kujertaa-, Heidät edelleen yhdistyvät sähköstaattisesta vetovoimasta. Tällä ammoniumasetaattikiteellä on ortorrominen rakenne, jota voidaan havaita mikroskooppisissa näytteissä tai jopa näkyvissä koossa.
Voi palvella sinua: Ionilinkki: Ominaisuudet, miten se muodostuu ja esimerkkejäTämän suolan ioninen sidos ei ole vain tärkeä, vaan myös vety sillat. NH4+ Voit lahjoittaa jopa neljä näistä siltoista; Toisin sanoen jokaisessa sen tetraedronin kärkipisteessä on happiatomi CHO: sta3Kujertaa- naapuri (H3N+-H-ACH3-A.
Teoriassa heidän kiteidensä sisällä olevien voimien tulisi sitten olla erittäin vahvoja; Mutta kokeellisesti tapahtuu päinvastoin, koska se sulaa vain 114 ° C. Siksi vety sillat eivät kompensoi niiden ionisen sidoksen heikkoutta eikä NH -ortorromin lasin alhainen retikulaarinen energia4CH3Kujertaa.
Muut koostumukset ja vesi
Aluksi sanottiin, että ammoniumasetaatti valmistetaan sekoittamalla etikka- ja ammoniakkihappo. Siksi suola voidaan ilmaista myös seuraavasti: NH3CH3Haittaa. Siten koostumuksesta riippuen voidaan saada muita rakenteita: NH3· 2Ch3Cooh, o nh3· 5Ch3Esimerkiksi cooh.
Mainittiin myös, että se imee tarpeeksi kosteutta. Näin toimiessaan se sisältää vesimolekyylit kiteisiin, jotka on hydrolysoitu NH: n antaminen3 tai ch3Cooh; Ja siksi suola emittoi ammoniakin tai etikan hajun.
Ominaisuudet
Fyysinen ulkonäkö
Herkulliset valkoiset kiteet, joissa ei ole etikkaa ja ammoniakkia.
Moolimassa
77 083 g/mol.
Tiheys
1 073 g/ml 25ºC: n lämpötilassa.
Sulamispiste
114ºC. Tämä arvo on huomattavasti alhaisempi verrattuna muihin suoloihin tai ionisiin yhdisteisiin. Lisäksi siitä puuttuu kiehumispiste ammoniakin muodostumisen vuoksi, mikä tarkoittaa suolan hajoamista.
Liukoisuus
143 g/100 ml 20 ° C: ssa. Huomaa poikkeuksellinen veden liukoisuus, joka osoittaa affiniteetin, jonka vesimolekyylit tuntevat NH -ioneissa4+ ja ch3Kujertaa-, Heillä vesipitoisilla palloilla.
Voi palvella sinua: Hume-rothery -säännötHänen liukoisuus ei ole niin vähemmän polaarisia liuottimia. Esimerkiksi 100 ml: ssa metanolia 15 ° C: ssa 7,89 g NH: ta liuottaa4CH3Kujertaa.
Vakaus
Se on herkullista, joten sinun tulisi välttää säilyttämistä märissä tiloissa. Myös veden absorbointi vapauttaa ammoniakkia, ja siksi se hajoaa.
Pka
9.9.
Tämä vakio vastaa ammoniumionien happamuutta:
Nh4+ + B NH3 + HB
Missä HB on heikko happo. Jos B -emäs on vesi, sen hydrolyysireaktio on reaktio:
Nh4+ + H2Tai NH3 + H3JOMPIKUMPI+
Missä lajissa H3JOMPIKUMPI+ Määritä liuoksen ph.
Toisaalta asetaatti myötävaikuttaa myös pH: n:
CH3Kujertaa- + H2Tai ch3COOH + OH-
Siten molemmat lajit H3JOMPIKUMPI+ ja oh- Ne neutraloidaan antamalla pH 7, neutraali. Pubchemin mukaan ammoniumasetaatin erittäin konsentroituneilla liuoksilla on kuitenkin happama pH; mikä tarkoittaa, että NH -hydrolyysi hallitsee4+ Tietoja valitsemasta3Kujertaa-.
Vakiokoulutuksen entalpia
ΔFH298 = -615 kJ/mol.
Sovellukset
Analyyttinen
Vesipitoiset natriumasetaat liuokset mahdollistavat lyijyn, raudan ja sinkkisulfaattien liuottamisen, sen jälkeen niiden pitoisuuden määrittäminen atomien absorptiospektroskopialla.
Puoliksi kuljettaja
Matalan lämpötilan aterioina muihin suoloihin verrattuna sen nestettä voidaan käyttää polttimon piirin kytkemiseen sähkövirran ohjaamiseen.
Puskuri
Voit säädellä happamien tai emäksisten väliajojen pH -muutoksia, joita käytetään jatkuvan pH: n ylläpitämiseen esimerkiksi lihassa, suklaissa, juustoissa, vihanneksissa tai muissa elintarvikkeissa.
Voi palvella sinua: molybdeeniJäällä ja lattialla
Se on biohajoava ja suhteellisen halpa suola, jota käytetään ICE -polkujen sulattamiseen. Koska se on vesiliukoisen typen lähde, se on tarkoitettu maatalouden käyttötarkoitukseen kaliumpitoisuuksien määrittämiseksi.
Saostumisaine
Tätä suolaa käytetään proteiinin saostamiseen kromatografisen analyysin suorittamiseen.
Lääke
Ammoniumasetaatti toimii eläinlääketieteellisenä diureettina, ja se on myös välttämätön suola insuliinin ja penisilliinisynteesille.
Riskejä
Seuraava ja lopuksi ammoniumasetaatin aiheuttamat negatiiviset riskit tai seuraukset on lueteltu:
- Se voi aiheuttaa pieniä ärsytyksiä iholla, mutta imeytymättä siihen.
- Kun nielty aiheuttavat vatsaa, ripulia, diureesiä, ahdistusta, suurempaa virtsaarvetta, vapinaa ja muita ammoniakkien myrkytykseen liittyviä oireita sekä maksa vaurioittaa.
- Hänen hengityksensä ärsyttää nenää, kurkkua ja keuhkoja.
Muista ei tiedetä, voiko syöpä tuottaa, ja mahdollinen tulen riski tällä suolalla hylätään (ainakin normaaleissa varastointiolosuhteissa).
Viitteet
- Inger Nahringbauer. (1967). Vety sidostutkimukset. XIV. Ammoniumasetaatin kiderakenne. Kemian instituutti, Uppsalan yliopisto, Uppsala, Ruotsi. Kristalli. 23, 956.
- Kansallinen bioteknologiatietojen keskus. (2019). Ammoniumasetaatti. Pubchem -tietokanta. CID = 517165. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Sullivan Randy. (2012). Ammoniumasetaatin johtavuus. Talteenotettu: Chemdemos.Uoregon.Edu
- Viachem, Ltd. (S.F.-A. Ammoniumasetaatti. Toipunut: Viacheminc.com
- Wikipedia. (2019). Ammoniumasetaatti. Haettu: vuonna.Wikipedia.org
- New Jerseyn terveysministeriö. (2012). Ammoniumasetaatti: vaarallisten aineiden tietolomake. [PDF]. Palautettu: NJ.Hallitus
- Xueyanghu. (S.F.-A. Ammoniumasetaatin käyttö ja riskit. Toipunut: Xueyanghu.WordPress.com
- « Alizariinin ominaisuudet, valmistelu, käyttö ja toksisuus
- Rautahydroksidi (III) rakenne, ominaisuudet ja käyttötarkoitukset »

