Etyyliasetaatti
- 1429
- 277
- Shawn Stanton II
Hän etyyli- tai etyylietaaniasetaatti Se on orgaaninen yhdiste, jonka kemiallinen kaava on Cho3Keittää2H5. Se koostuu esteristä, jossa alkoholikomponentti on peräisin etanolista, kun taas sen karboksyylihappokomponentti tulee etikkahaposta.
Se on neste normaalissa lämpötila- ja paine -olosuhteissa, ja siinä on tuoksu, joka on miellyttävä hedelmille. Tämä ominaisuus tulee täydellisesti harmoniaan, joten sen odotetaan esteriltä; joka on itse asiassa etyyliasetaatin kemiallinen luonne. Tästä syystä hän löytää käyttöä elintarvikkeissa ja alkoholijuomissa.
 Etyyliasetaatti. Lähde: Commons Wikimedia.
Etyyliasetaatti. Lähde: Commons Wikimedia. Yläkuva näyttää etyyliasetatodin luurankojen rakenteen. Huomaa sen karboksyylihappokomponentti ja oikealle alkoholikomponentti. Rakenteellisesta näkökulmasta tämän yhdisteen voidaan odottaa käyttäytyvän kuin hybridi etikan ja alkoholin välillä; Se osoittaa kuitenkin omat ominaisuutensa.
Tässä tällaiset esterit kutsuvat hybridit erottuvat erilaisista. Etyyliasetaatti ei voi reagoida kuin happo, eikä dehydraattia OH -ryhmän puuttuessa. Sen sijaan se kärsii emäksisestä hydrolyysistä vahvan emäksen, kuten natriumhydroksidin, läsnä ollessa, NaOH.
Tätä hydrolyysireaktiota käytetään laboratorioiden opettamisessa kemiallisissa kinetiikkakokeissa; missä reaktio on lisäksi toinen järjestys. Kun hydrolyysi tapahtuu, Ethilin etanoaatti.
Rakenteellisessa luurankoissaan havaitaan, että happea koskevassa vetyatomeissa on vallitseva. Tämä vaikuttaa sen kykyyn olla vuorovaikutuksessa ei niin polaaristen lajien kanssa kuin rasvat. Sitä käytetään myös yhdisteiden, kuten hartsien, väriaineiden ja yleensä orgaanisten kiinteiden aineiden liuottamiseen.
Huolimatta miellyttävästä aromista, pitkäaikainen altistuminen tälle nesteelle tuottaa negatiivisen vaikutuksen (kuten melkein kaikki kemialliset yhdisteet) kehossa.
Etyyliasetaatirakenne
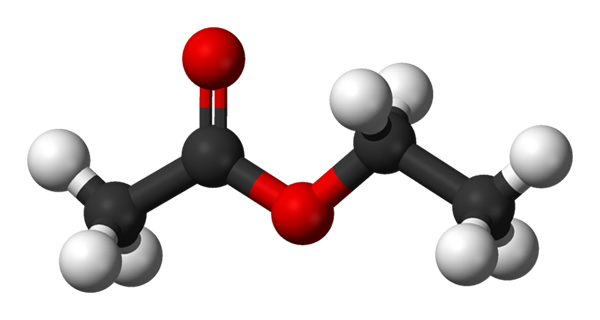
 Pallot ja baarimalli etyyliasetaatille. Lähde: Benjah-BMM27 [julkinen alue]
Pallot ja baarimalli etyyliasetaatille. Lähde: Benjah-BMM27 [julkinen alue] Yläkuva näyttää etyyliasetaatin rakenteen pallo- ja tankojen mallilla. Tässä mallissa korostetaan happiatomit, joissa on punaiset pallot; Vasemmalla puolella on happosta peräisin oleva fraktio ja oikealla puolella oleva fraktio, joka on johdettu alkoholista (alkoholi, -or).
Voi palvella sinua: Heikot elektrolyyttit: käsite, ominaisuudet, esimerkitKarbonyyliryhmä voidaan nähdä linkillä c = O (kaksoispalkit). Tämän ryhmän ympärillä oleva rakenne ja viereinen happi on tasainen, koska molempien hapen välillä on resonanssikuormitus uudelleen; tosiasia, joka selittää a -hydrogeneiden suhteellisen alhaisen happamuuden (3, linkitetty C = O).
Molekyyli, joka pyörii kahta linkkiä, suosii suoraan, kuinka vuorovaikutuksessa muiden molekyylien kanssa. Kahden happiatomin läsnäolo ja epäsymmetria rakenteessa antavat sille pysyvän dipolimomentin; joka puolestaan on vastuussa sen dipoli-dipolin vuorovaikutuksesta.
Esimerkiksi elektroninen tiheys on suurempi lähellä kahta happiatomia, vähenee huomattavasti -CH -ryhmässä3, Ja vähitellen OCH -ryhmässä2CH3.
Näiden vuorovaikutusten vuoksi etyyliasetaattimolekyylit muodostavat nesteen normaaleissa olosuhteissa, joilla on huomattavasti korkea kiehumispiste (77ºC).
Atomien puuttuminen vety sillasta
Jos rakennetta havaitaan huolellisesti, havaitaan atomin, joka kykenee luovuttamaan vety -sillan. Happiatomit ovat kuitenkin sellaisten hyväksyttäjiä, ja etyyliasetaatti on hyvin liukoinen veteen, ja se on vuorovaikutuksessa arvioidussa asteessa polaaristen yhdisteiden ja vety sillojen luovuttajien kanssa (kuten sokerit).
Sen avulla voit myös olla vuorovaikutuksessa etanolin kanssa; Syy, miksi sen läsnäolo alkoholijuomissa ei ole yllättynyt.
Toisaalta hänen alkoholiryhmänsä saa hänet kykenemään olemaan vuorovaikutuksessa tiettyjen apolaaristen yhdisteiden, kuten kloroformin kanssa, ch3Cl.
Fysikaaliset ja kemialliset ominaisuudet
Nimeä
-Etyyliasetaatti
-Etyylietanoaatti
-Etikkahalli
-Asetoksitano
Molekyylikaava
C4H8JOMPIKUMPI2 tai ch3Keittää2H5
Molekyylipaino
88 106 g/mol.
Fyysinen kuvaus
Kirkas väritön neste.
Väri
Väritön neste.
Haju
Eetterille ominainen, samanlainen kuin ananashaju.
Maku
Mukava laimennettuna, se tuo hedelmämakua oluelle.
Hajukynnys
3,9 ppm. 0,0196 mg/m3 (matala haju); 665 mg/m3 (Korkea haju).
Voi palvella sinua: kemiallinen sidosPieni haju 7 - 50 ppm: ssä (keskiarvo = 8 ppm).
Kiehumispiste
171 ºF 760 mmHg (77,1 ºC).
Sulamispiste
-118,5 ºF (-83,8 ºC).
Vesiliukoisuus
80 g/l.
Liukoisuus orgaanisiin liuottimiin
Sekoittuu etanolin ja etyylieetterin kanssa. Erittäin liukoinen asetoniin ja bentseeniin. Sekoittuu kloroformin, kiinteiden öljyjen ja haihtuvien kanssa, ja myös hapetettujen ja kloorattujen liuottimien kanssa.
Tiheys
0,9003 g/cm3.
Höyrytiheys
3,04 (ilmassa: 1).
Vakaus
Se hajoaa hitaasti kosteuden kanssa; yhteensopimattomia useiden vahvojen hapettavien muovien ja agenttien kanssa. Seos vedellä voi olla räjähtävää.
Höyrynpaine
93,2 mmHg 25 ºC: n lämpötilassa
Goo
0,423 mpoise 25 ° C: ssa.
Palamislämpö
2.238,1 kJ/mol.
Höyrystyslämpö
35,60 kJ/mol 25 ° C: ssa.
Pintajännitys
24 dynas/cm 20 ° C: ssa.
Taitekerroin
1 373 - 20 ºC/D.
Säilytyslämpötila
2 - 8 ºC.
Pka
16 - 18 - 25 ºC.
Synteesi
Fisher -reaktio
Etyyliasetaatti syntetisoidaan teollisesti Fisherin reaktiolla, jossa etanoli esteröidaan etikkahapolla. Reaktio tapahtuu huoneenlämpötilassa.
CH3CH2Voi +ch3Cooh ch3Keittää2CH3 + H2JOMPIKUMPI
Reaktiota kiihtyy happokatalyysillä. Tasapaino siirtyy oikealle, toisin sanoen etyyliasetaatin tuotantoon poistamalla vettä; Massatoimenpiteen mukaan.
Tishchenko -reaktio
Etyyliasetaatti valmistetaan myös teollisesti käyttämällä Tishchenko -reaktiota, konjugoimalla kaksi asetaldehydiekvivalenttia käyttämällä katalyyttiä katalyyttinä.
2 ch3Cho => Cho3Keittää2CH3
Muut menetelmät
-Etyyliasetaatti syntetisoidaan co -tuotteena butaanin hapettumisessa etikkahapossa, reaktiossa, joka on valmistettu lämpötilassa 175 ºC ja 50 atm painetta. Sitä käytetään kobolttikatalysaattorina ja kromi -ioneina.
-Etyyliasetaatti on polyvinyylipolyvinyyliasetaatin etanolin Co -tuote.
-Etyyliasetaattia tuotetaan myös teollisuudessa etanolin dehydralla, katalysoimalla reaktiota käyttämällä kuparia korkeassa lämpötilassa, mutta alle 250 ºC.
Sovellukset
Liuotin
Etyyliasetaattia käytetään liuottimena ja laimentajana käyttämällä piirilevyjen puhdistusta. Sitä käytetään liuottimena modifioidun humalauutteen valmistuksessa ja kofeiinitussa kahvi- ja teelehdessä. Sitä käytetään musteissa, joita käytetään hedelmien ja vihannesten merkitsemiseen.
Se voi palvella sinua: Syanhydrinen happo: molekyylirakenne, ominaisuudet, käyttötarkoituksetEtyyliasetaattia käytetään tekstiiliteollisuudessa puhdistusaineena. Käytetään lämpömittarien kalibroinnissa, jota käytetään sokerien erotuksessa. Maaliteollisuudessa sitä käytetään käytettyjen materiaalien liuottimena ja laimentajana.
Keinotekoiset maut
Sitä käytetään hedelmämakujen kehittämisessä; Esimerkiksi: banaani, päärynä, persikka ja ananas, samoin kuin rypäleen tuoksu jne.
Analytiikka
Sitä käytetään vismutin, boorin, kullan, molybdeenin ja platinan määrittämisessä sekä Taliumin liuottimessa. Etyyliasetaatilla on kyky erottaa monia yhdisteitä ja elementtejä, jotka ovat läsnä vesiliuoksessa, kuten: fosfori, koboltti, volframi ja arseeni.
Orgaaninen synteesi
Etyyliasetaattia käytetään teollisuudessa formulaatioissa käytettyjen hartsien viskositeettina pelkistimena. Sitä käytetään asetamidituotannossa, asetyyliasetaatissa ja metyyliseptanonissa.
Kromatografia
Laboratorioissa etyyliasetaattia käytetään kromatografioiden liikkuvana faasina sarakkeissa ja uuttoliuottimena. Etyyliasetaattilla on suhteellisen alhainen kiehumispiste, se on helppo haihduttaa, minkä avulla voit keskittää liuenneen aineet liuottimeen.
Hyönteistiede
Entomologiassa käytetään etyyliasetaattia säiliöön sijoitettujen hyönteisten tukahduttamiseksi, mikä mahdollistaa sen keräämisen ja tutkimuksen. Etyyliasetaatihöyryt tappavat hyönteisen tuhoamatta sitä ja välttämättä niiden kovettumista, helpottaen heidän kokoelmakokoonpanoa.
Riskejä
-Ldviisikymmentä Etyyliasetaatista rotilla, se osoittaa alhaisen myrkyllisyyden. Se voi kuitenkin ärsyttää ihoa, silmiä, ihoa, nenää ja kurkkua.
-Altistuminen korkealle tasoille voi aiheuttaa huimausta ja pyörtymistä. Samoin pitkäaikainen altistuminen voi vaikuttaa maksaan ja munuaiseen.
-Etyyliasetaatin hengitys pitoisuudella 20.000 - 43.000 ppm, voi tuottaa keuhkojen turvotusta ja verenvuotoa.
-OSHA on asettanut työvoimanäyttelyrajan 400 ppm ilmassa keskimäärin 8 tunnin työvuoron aikana.
Viitteet
- Orgaanisen kemian havainnollistettu sanasto: ethyyliasetaatti (EtOAC). Palautettu: Chem.UCLA.Edu
- Eethyyliasetaatti. Haettu osoitteesta: CHM.Bris.Ac.Yhdistynyt kuningaskunta

