Natriumasetaatirakenne, ominaisuudet, synteesi, käyttää

- 1405
- 320
- Juan Breitenberg V
Hän natriumasetaattia Se on etikkahapon natriumsuola, jonka molekyylinen kaava on c2H3JOMPIKUMPI2Naa. Se koostuu herkullisesta valkoisesta jauheesta, jota esiintyy olennaisesti kahdessa muodossa: vedettömän ja trihydraatti. Molemmat ovat hyvin liukenevia veteen, yleiseen liuottimeen; Mutta ei niin liukene alkoholiin tai asetoniin.
Anhydra -muodossa on tiheys, fuusio ja kiehumispiste, jolla on korkeammat arvot kuin natriumasetaatin trihydraattimuodossa esitetyt. Tämä johtuu siitä, että vesimolekyylit häiritsevät Na -ionin vuorovaikutusten välillä+ ja ch3Kujertaa-.
 Natriumasetaatin ulkonäkö
Natriumasetaatin ulkonäkö Natriumasetaatti on stabiili, varsinkin jos sitä säilytetään välillä 2 - 8 ºC; Mutta se on alttiita voimakkaiden hapettavien aineiden ja halogeenien vaikutukselle.
Se voidaan valmistaa natriumbikarbonaatin reaktiolla etikkahapon kanssa. Myös etikkahapon reaktiolla natriumhydroksidilla. Molemmat reaktiot ovat helppo kehittää ja alhaiset taloudelliset kustannukset; Ensimmäinen jopa voidaan tehdä kotona.
Tämä suola on vähän myrkyllinen yhdiste. Tuottaa ihon ärsytystä vasta usein ja jatkuvan kosketuksen jälkeen. Se on vähän ärsyttävää silmille, mutta voi ärsyttää hengitysteitä. Nielemisen haitallisista vaikutuksista ei ole tietoa.
Sillä on lukuisia käyttötarkoituksia ja sovelluksia, jotka korostavat sen pH -vaimennustoimintoa yhdessä etikkahapon kanssa. Asetaatti -iskunvaimentimella on PKA = 4,7; joka antaa korkean hyötysuhteen pH: n säätelyssä happamassa ympäristössä, jonka pH -arvot ovat välillä 3 - 6.
Matalan myrkyllisyyden ja ominaisuuksien vuoksi sitä on käytetty laajasti ruoan maun parantamiseksi, samoin kuin aine, joka tarjoaa suojaa heidän hajoamiselta johtuen niiden vaikutuksista mikrobeja vastaan.
[TOC]
Natriumasetaatirakenne
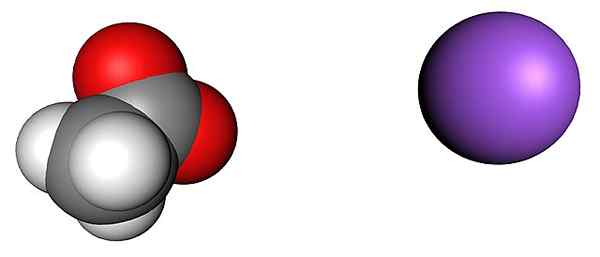 Asetaatti- ja natriumioneja. Lähde: SHU0309 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Asetaatti- ja natriumioneja. Lähde: SHU0309 [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Yläkuva näyttää ionit, jotka muodostavat vedettömän natriumasetaattikiteitä (ilman vettä). Purple -pallo vastaa nakationia+, Ja vasemmalla oleva molekyyli -ioni on asetaatti, CHO3Kujertaa-, Punaisten pallojen edustamilla happiatomilla.
Nämä ikätoverit, Chip CH: n mukaan3Polku, on 1: 1 -suhteessa; Jokaiselle CHO: lle3Kujertaa-, On oltava napaatio+ houkuttelee sen negatiivinen kuorma ja päinvastoin. Siten niiden väliset nähtävyydet ja tasavertaisten kuormitusten väliset torjunnot lopulta muodostuvat rakenteelliset kuviot, jotka määrittelevät kiteen, jonka minimaalinen ekspressio on yhtenäinen solu.
Tämä yhtenäinen solu, kuten kokonaisuutena, vaihtelee ionien sijoittamisesta avaruuteen; Se ei ole aina sama, edes samalle kiteiselle järjestelmälle. Esimerkiksi vedetön natriumasetaatti voi muodostaa kaksi ortorromista polymorfia, joista yksi on esitetty alla:
 Natriumasetaatin ortoromisten kiteiden yhtenäinen solu. Lähde: Benjah-BMM27 [julkinen alue]
Natriumasetaatin ortoromisten kiteiden yhtenäinen solu. Lähde: Benjah-BMM27 [julkinen alue] Huomaa ionien järjestely: neljä Cho -ionia3Kujertaa- He sulkevat Na+ Sillä tavalla, että he "piirtävät" vääristyneen neliön pohjapyramidin. Jokainen näistä CHO: sta3Kujertaa- vuorostaan vuorovaikutuksessa toisen Na: n kanssa+ viereinen.
Hydratoidut kiteet
Natriumasetaatilla on paljon affiniteettia veteen; Itse asiassa se on herkullista, toisin sanoen se säilyttää kosteuden, kunnes se on liuennut samaan. Mitä suurempi kosteus, nopeammin se on "sulaa". Tämä johtuu niin niin3Kujertaa- Kuten Na+ He voivat hydroida, ympäröida itseään vesimolekyyleillä, jotka ohjaavat heidän dipoleitaan kohti kuormiaan (na+ vai niin2, CH3Kujertaa- Hoh).
Voi palvella sinua: Hopeabromidi (AGBR): rakenne, ominaisuudet ja käytötKun tämä suola valmistetaan laboratoriossa tai kotona, se on niin affiniteetti veteen, että jopa normaaleissa lämpötiloissa saadaan jo hydraattina; CH3Pata · 3h2JOMPIKUMPI. Niiden kiteet lakkaavat olemasta ortorromisia ja niistä tulee monokliinisiä, koska ne sisältävät nyt kolme vesimolekyyliä jokaiselle parille CHO: lle3Kujertaa- ja na NA+.
Ominaisuudet
Nimeä
-Natriumasetaattia.
-Natriumetanoaatti (IUPAC).
Moolimassa
-Vedetön: 82,03 g/mol.
-Triihydratoitu: 136,03 g/mol.
Näkökohta
Herkullinen valkoinen jauhe.
Haju
Etikkaa, kun hänet lämmitetään hajoamiseen.
Tiheys
-Anhidro: 1, 528 g/cm3 20 ºC.
-Triihydratoitu: 1,45 g/cm3 20 ºC.
Sulamispiste
-Anhidro: 324 ºC (615 ºF, 597 K).
-Triohydraatti: 58 ºC (136 ºF, 331 K).
Kiehumispiste
-Anhidro: 881,4 ºC (1.618,5 ºF, 1.154,5 K).
-TriHydraatti: 122 ºC (252 ºF, 395 K). Se hajoaa.
Liukoisuus
Vedessä
-Anhydro: 123,3 g/100 ml 20 ° C: ssa.
-Triihydratoitu: 46,4 g/100 ml 20 ºC: n lämpötilassa.
Metanolissa
16 g/100 g 15 ° C: ssa.
Etanolissa
5,3 g/100 ml (trihydraatti).
Asetonissa
0,5 g/kg 15 ° C: ssa.
Happamuus
PKA: 24 (20 ºC).
Perusteetti
PKB: 9.25. Tässä on selvää, että natriumasetaatti on perussuola, jotta PKB: n on oltava vähemmän kuin sen PKA.
Taiteindeksi (ηD)
1 464
Kalorikapasiteetti
-100,83 j/mol · k (vedetön).
-229,9 J/mol · K (trihydrado).
sytytyspiste
Yli 250ºC.
Itsekiinnityslämpötila
600 ºC.
PHE
8,9 (liuos 0,1 m - 25 ºC).
Vakaus
Vakaa. Yhteensopimattomia vahvojen ja halogeenien hapettujen aineiden kanssa. Kosteus.
Reaktiot
Natriumasetaatti voi muodostaa esterin reagoimalla vuokra -halogenidilla; Esimerkiksi bromoetano:
CH3Poron +Brch2CH3 => Ch3Keittää2CH3 + NABR
Natriumasetaatti on dekarboksyla metaanin (pyrolyysi) muodostamiseksi NaOH: n läsnä ollessa:
CH3Poon +naoh => ch4 + Naa2Yhteistyö3
Cesio -myynti katalysoi reaktiota.
Synteesi
Natriumasetaattia voidaan tuottaa edullisin kustannuksin laboratoriossa reagoimalla natriumbikarbonaattia etikkahapon kanssa:
Nahco3 + CH3Cooh => ch3Polku +h2Yhteistyö3
Tähän reaktioon liittyy läsnäolo voimakkaan kuplan liuoksessa johtuen hiilihapon hajoamisesta vedessä ja hiilidioksidissa.
H2Yhteistyö3 => H2Tai +Co2
Teollisesti natriumasetaattia tuotetaan etikkahapon reaktiolla natriumhydroksidin kanssa.
CH3Cooh +naoh => ch3Polku +h2JOMPIKUMPI
Sovellukset
Lämpöpussit
Lämpöpussien valmistukseen käytetään natriumasetaattia.
Alun perin suolakiteet liuotetaan veden tilavuuteen liuoksen valmistukseen, joka muuttuu ylikyllästetyksi.
Sitten liuos lämpötilassa, joka on yli 58 ºC, joka on sen sulamispiste. Huoneen lämpötilan ylikyllästetyn liuoksen annetaan jäähtyä ja kiteiden muodostumista ei havaita; Ratkaisu on yli -Chirp.
Voi palvella sinua: jaksollinen taulukko, mihin se onKiteiden puuttuminen selitetään, että nestemäiset molekyylit ovat liian sotkuisia eikä niillä ole asianmukaista ohjeita kiteytymislämpötilan saavuttamiseksi. Neste on metastabiilissa tilassa, epätasapainon tilassa.
Antaa. Lämpöpussien tapauksessa painetaan mekaaninen kiinnitys nesteen sekoittamiseksi ja kiteiden muodostumisen aloittamiseksi ja trihydratoituneen natriumasetaattiliuoksen kiinteyttäminen.
Kiteytymisen tapahtuessa lämpötila nousee. Triihydratoidut natriumasetaattikiteet hankkivat jään ulkonäön, mutta ne ovat kuumia, joten sitä kutsutaan "kuuma jää".
Teollisuuden edustajat
-Natriumasetaattia käytetään tekstiiliteollisuudessa petoksena kudoksen värjäysprosessissa
-Neutraloi rikkihappojätteet
-Sillä on käytettävä puuvillankäsittelyssä puuvillatyynyjen laatimiseen, henkilökohtaiseen puhdistukseen käytettävissä ja lääketieteellisiin tarkoituksiin
-Sitä käytetään metallipitlingissä ennen kromia
-Yhteistyössä niin, että kloropreenin vulkanoituminen ei tapahdu synteettisessä kumin tuotantoprosessissa
-Puuttuu glukoosin puhdistamiseen
-Sitä käytetään nahkoissa.
Lääketieteellinen käyttö
Natriumasetaatti on osa yhdisteitä.
Sitä käytetään natriumpitoisuuksien korjaamiseen hyponatemian potilailla, myös metabolisen asidoosin ja virtsan alkalaation korjaamisessa.
PH -vaimennusliuos
Sitä käytetään pH -säätelijänä monissa entsymaattisissa reaktioissa, jotka tapahtuvat pH 3: n ja pH: n välillä.
Asetaattipuskuriliuoksen erilainen pH saavutetaan etikkahapon ja natriumasetaatin konsentraation variaatiolla.
Esimerkiksi pH: n 4,5: n saamiseksi puskuriliuoksen etikkahappopitoisuus on 3,8 g/l ja vedettömän natriumasetaatin pitoisuus 3,0 g/l.
Asetaattipuskuriliuoksen pitoisuus voidaan lisätä, mikä kasvaa samassa suhteessa, joka tarvitaan halutun pH: n saamiseksi tarvittavan liuoksen komponentit.
Asetaatti-/asetonitriilisimunvaimennusta käytetään kapillaarielektroforeesissa fotoberberiinin erotuksessa.
Tutkimuslaboratoriot
-Natriumasetaatti on heikko nukleofiilinen aine, jota käytetään β-laktonin anionisessa polymeroinnissa.
-Sitä käytetään reagenssina biologisten makromolekyylien ydinmagneettiresonanssissa.
-Sitä käytetään solujen solujen uuttoon. Natrium on kationi, joka on vuorovaikutuksessa DNA: ssa läsnä olevien negatiivisten fosfaattien kanssa, mikä auttaa sen kondensaatiossa. Etanolin läsnä ollessa DNA muodostaa sakan, joka voidaan sitten erottaa vesikerroksesta.
Elintarvikkeiden säilyttäminen
-Se auttaa estämään bakteerien kasvu.
-Asetaatissa läsnä oleva natrium parantaa ruoan makua.
-Natriumasetaattia käytetään vihannesten suolakurkkujen valmistuksessa: kurkku, porkkana, sipuli jne. Lisäksi sitä käytetään lihan säilyttämisessä.
Voi palvella sinua: Dimetylanyliini: rakenne, ominaisuudet, synteesi, käyttääBetonin säilyttäminen
Betonia vaurioituu veden vaikutuksesta, joka lyhentää sen kestoa. Natriumasetaatti toimii betonin tiivisteaineena, joka vedenpitävä se veteen, pidentäen sen alkuperäisiä ominaisuuksia.
Nuoret kokeet
Koe 1
Yksinkertainen koe on natriumasetaattisynteesi natriumbikarbonaattireaktion kautta etikan kanssa (5%etikkahappo).
30 ml etikkaa asetetaan dekantterilasiin ja lisätään noin 3,5 g bikarbonaattia.
Reaktiossa muodostetaan natrium- ja hiilihappomuodot. Happo hajoaa hiilidioksidiksi ja veteen. Hiilidioksidin muodostuminen tuottaa voimakkaan kuplan liuoksessa.
Natriumasetaatin keräämiseksi veden haihtuminen on aiheuttanut, liuoksen lämmittäminen.
Koe 2
Toinen yksinkertainen koe on natriumitrihydraattiasetaatin muodostuminen.
Tätä varten, noin 20 g natriumasetaattia trihydraattia ja asetettu dekantterilasiin, lisäämällä sitten 10 ml vettä, lisäämällä sitten 10 ml vettä. Liuos kuumennetaan yli 58 ºC: n lämpötilaan.
Natriumasetaatti on täysin liuennut sen varmistamiseksi. Aikaisemmin Pietri -kapseli asetetaan kylmälle pinnalle.
Pietrin kapselin trihydraattiasetaatin dekantterilasiin sisältö kaadetaan hitaasti. Kapselin nesteen lämpötila alkaa laskeutua, jopa sulamispisteen alla tarkkailematta trihydraattisen natriumasetaatin kiteyttämistä tai kiinteyttämistä.
Yleensä trihydratoituneen natriumasetaatin kiteytymisen tuottamiseksi lisätään pieni määrä suolaa, jotta se toimisi kiteytymisydintä. Muina aikoina liuoksessa on pieni häiriö, natriumasetaatin kiteytymisen aloittamiseksi.
Triihydratoitu natriumasetaattikiteitä näyttää jäältä, mutta jos niitä kosketetaan, huomataan, että ne ovat suhteellisen kuumia. Tästä syystä suolaa kutsutaan "kuuma jää".
Myrkyllisyys
Natriumasetaatti on hyvin pieni myrkyllinen yhdiste. Se ei myöskään luokitella ihon ja hengitysteiden herkistäjään.
Lisäksi natriumasetaattia ei luokitella mutageeniseksi aineeksi itu-, syöpää aiheuttavissa tai myrkyllisissä soluissa lisääntymiseen.
Lyhyesti sanottuna, se on vähän ärsyttävää silmille. Hengitysteitä voidaan ärsyttää heidän hengityksen jälkeen. Usein ja jatkuva kosketus ihon kanssa voi aiheuttaa sen ärsytystä.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Kemikaalien maailma. (16. tammikuuta 2017). Kuinka valmistaa natriumasetaatti kotona? Palautettu: väliaine.com
- Kansallinen bioteknologiatietojen keskus. (2019). Natriumasetaattia. Pubchem -tietokanta. CID = 517045. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- S. Cameron, k. M. Mannan ja M. JOMPIKUMPI. Rahman. (1976). Natriumasetaattin kiderakenne. Kristalli. B32, 87.
- Wikipedia. (2019). Natriumasetaattia. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (24. tammikuuta 2019). Tee kuuma jää etikasta ja ruokasoodasta. Toipunut: Admingco.com
- Kemiallinen kirja. (2017). Natriumasetaattia. Palautettu: Chemicalbook.com
- Wasserman Robin. (2019). Natriumasetaatin käyttö. Toipunut: Livestrong.com
- Lääkekankki. (2019). Natriumasetaattia. Toipunut: Drugbank.Ac

