Primaarinen alkoholirakenne, ominaisuudet, nimikkeistö, esimerkit

- 3878
- 962
- Gustavo Runte DVM
Eräs ensisijainen alkoholi Se on yksi, jossa hydroksyyliryhmä on kytketty ensisijaiseen hiileen; Tämä on kovalenttisesti kiinnittynyt hiili toiseen hiileen ja vetyihin. Hänen yleinen kaava on Roh, erityisesti rch2Voi, koska vuokra -ryhmä r on vain yksi.
RCH Formula R -ryhmä R2Voi se voi olla kuka tahansa: ketju, rengas tai heteroatomeja. Kun kyse on ketjusta, lyhyt tai pitkä, se on ennen edustavia ensisijaisia alkoholeja; Heidän joukossaan ovat metanoli ja etanoli, kaksi syntetisimmin teollisuustasoilla.
 Olutpurkki: Esimerkki etyylialkoholin, primaarisen alkoholin vesiliuoksesta orgaanisessa matriisissa. Lähde: Engin Akyurt Pexelsin kautta.
Olutpurkki: Esimerkki etyylialkoholin, primaarisen alkoholin vesiliuoksesta orgaanisessa matriisissa. Lähde: Engin Akyurt Pexelsin kautta. Fyysisesti he ovat kuin muut alkoholit, ja niiden kiehumis- tai fuusiopisteet riippuvat niiden seurausten asteesta; Mutta kemiallisesti ne ovat reaktiivisimpia. Lisäksi sen happamuus on parempi kuin sekundaariset ja kolmannen asteen alkoholit.
Ensisijaiset alkoholit kokevat hapettumisreaktioita, joista tulee laaja määrä orgaanisia yhdisteitä: esterit ja eetterit, aldehydit ja karboksyylihapot. Ne voivat myös kärsiä kuivumisreaktioista, tulla alkeeniksi tai olefiineiksi.
[TOC]
Primaarisen alkoholin rakenne
Lineaarisista alkanista johdetut ensisijaiset alkoholit ovat edustavia. Todellisuudessa kaikki rakenteet, riippumatta siitä, onko lineaarinen tai haarautunut, voidaan luokitella tämän tyyppisiin alkoholiin niin kauan kuin OH -ryhmä on kytketty CH: hen2.
Joten rakenteellisesti jokaisella on yhteistä ryhmän läsnäolo2Voi, nimeltään metyyloli. Tämän tosiasian ominainen ja seuraus on, että OH -ryhmä on vähemmän estetty; toisin sanoen se voi olla vuorovaikutuksessa ympäristön kanssa ilman muita atomeja, jotka estävät alueellisesti.
Myös vähemmän estämä OH tarkoittaa, että sitä kantava hiiliatomi, valitse2, voi kärsiä korvausreaktioista SN -mekanismin kautta2 (Bimolekulaarinen, ilman karbokaation muodostumista).
Toisaalta OH, jolla on suurempi vapaus olla vuorovaikutuksessa ympäristön kanssa, kääntyy voimakkaammiksi molekyylien välisiksi vuorovaikutuksiksi (vety sillalla), mikä puolestaan lisää fuusio- tai kiehumispisteitä.
Se voi palvella sinua: nikkelihydroksidi (III): rakenne, ominaisuudet, käytöt, riskitSe tapahtuu myös sen liukoisuuden kanssa polaarisiin liuottimiin, kunhan ryhmä R ei ole kovin hydrofobinen.
Ominaisuudet
Happamuus
Ensisijaiset alkoholit ovat kaikkein happamia. Jotta alkoholi käyttäytyy kuin brnsted -happo, ionin h on luovutettava+ Keskellä, sanoa vettä, tulla alkoholianionille:
ROH + H2KULTA- + H3JOMPIKUMPI+
Punaisen negatiivinen kuorma-, erityisesti RCH: sta2JOMPIKUMPI-, Tunne kahden C-H-sidoksen elektronien vähemmän vastenmielisyyttä kuin C-R-sidoksen elektronit.
Vuokraryhmä harjoittaa sitten suurinta torjuntaa, epävakauttaen RCH: ta2JOMPIKUMPI-; mutta ei niin paljon verrattuna siihen, että jos R -ryhmää on kaksi tai kolme, kuten toissijaisten ja kolmannen asteen alkoholien kanssa, vastaavasti.
Toinen tapa selittää primaarisen alkoholin suurin happamuus on elektronegatiivisuuden eron kautta, luomalla dipolimomentti: H2CΔ+-JOMPIKUMPIΔ-H. Happi houkuttelee elektronista tiheyttä molemmat CH: t2 h; Hiilen positiivinen osittainen kuormitus hylkää vähän vetyä.
Ryhmä R siirtää hiukan sähköistä tiheyttä CHO: lle2, joka auttaa vähentämään sen positiivista osittaista kuormaa ja sen kanssa hydyn kuormitusta varten. Mitä enemmän RA -ryhmiä, sitä alhaisempi, sitä heijastaminen ja h: n trendi vapautetaan h: ksi+.
Pka
Primaarisia alkoholeja pidetään heikoimpana happona kuin vettä, lukuun ottamatta metyylialkoholia, mikä on hiukan vahvempi. Metyylialkoholin PKA on 15,2; Ja etyylialkoholin PKA on 16,0. Samaan aikaan vesi PKA on 15,7.
Vesi, jota pidetään heikkona happona, kuten alkoholit, voi kuitenkin liittyä h+ Muuttua hydrium -ioniksi, H3JOMPIKUMPI+; eli se käyttäytyy kuin pohja.
Samoin primaariset alkoholit voivat kaapata vetyä; Varsinkin joissakin reaktioissa, jotka ovat omia, esimerkiksi niiden muutoksessa alkeeniksi tai oleiksi.
Kemialliset reaktiot
Vuokra halogeenuros -muodostuminen
Alkoholit reagoivat vetyhalogenidien kanssa alkyylihalogenidien tuottamiseksi. Alkoholien reaktiivisuus vety halogeenien edessä laskeutuu seuraavassa järjestyksessä:
Voi palvella sinua: hiiliTertiäärinen alkoholi> Toissijainen alkoholi> Ensisijainen alkoholi
ROH +HX => RX +H2JOMPIKUMPI
RX on ensisijainen alkyylihalogenidi (valitse3Cl, ch3CH2Br jne.-A.
Toinen tapa valmistaa alkyylihalogenuroja on tionilokloridin, synteettisen reagenssin reaktion kautta, primaarisen alkoholin kanssa, josta tulee alkyylikloridi. Tionilokloridi (Socl2) vaatii pyridiinin läsnäolon reagoimiseksi.
CH3(CH2-A3CH2Voi +Socl2 => Ch3(CH2-A3CH2Cl +niin2 + HCL
Tämä reaktio vastaa 1-penolin halogenointia 1-clloropentanoksi pyridiinin läsnä ollessa.
Primaaristen alkoholien hapettuminen
Alkoholit voidaan hapettua aldehydeille ja karboksyylihapoiksi reagenssista riippuen. Pyridiniumklorokromaatti (PCC) hapettaa primaarisen alkoholin aldehydiin käyttämällä dikloorimetaania liuottimena (CH2Cl2)
CH3(CH2-A5CH2Voi => Cho3(CH2-A5Koho
Tämä on 1-heptanolin hapettuminen 1-heptanaalissa.
Samaan aikaan kaliumpermanganaatti (KMNO4) alkoholia alkoholia ensin ja hapettunut sitten aldehydiin karboksyylihappoksi. Kun kaliumpermanganaattia käytetään alkoholien hapettamiseen, hiilihiilien 3 ja 4 välisen yhteyden katkaisua tulisi välttää.
CH3(CH2-A4CH2Voi => Cho3(CH2-A4Haittaa
Tämä on 1-heksanolin hapettuminen heksaanihapoksi.
Tällä menetelmällä on vaikea saada aldehydi, koska se hapettaa helposti karboksyylihappoa. Samanlainen tilanne havaitaan, kun kromihappoa käytetään alkoholien hapettamiseen.
E éteres -muodostelma
Primaariset alkoholit voivat tulla eettereiksi, kun ne kuumennetaan katalyytin, yleensä rikkihappojen läsnä ollessa:
2 rch2Voi => rch2Kisko2R +h2JOMPIKUMPI
Orgaaninen esares -muodostuminen
Alkoholin ja karboksyylihapon tiivistyminen, kalastajan esteröinti, katalysoima happo, tuottaa esterin ja veden:
Voi palvella sinua: Carbocation: muodostuminen, ominaisuudet, tyypit, stabiilisuusR'OH +RCOOH RCOOR ' +H2JOMPIKUMPI
Hyvin tunnettu reaktio on etanolin kanssa etikkahapon kanssa etyyliasetaatin antamiseksi:
CH3CH2Voi +ch3Cooh ch3Hölynpöly2CH3 + H2JOMPIKUMPI
Ensisijainen alkoholi on alttiin Fischer -sterifikaatioreaktioille.
Kuivuminen
Korkeissa lämpötiloissa ja happamassa väliaineessa, yleensä rikkihapolla, alkoholit dehydraatti aiheuttavat alkeenia vesimolekyylin menetyksellä.
CH3CH2Voi => h2C = ch2 + H2JOMPIKUMPI
Tämä on etanolin kuivumisreaktio etyleeniin. Sopivampi yleinen kaava tämän tyyppiselle reaktiolle, erityisesti ensisijaiselle alkoholille, olisi:
Rch2Oh => r = cho2 (Mikä on myös yhtä suuri kuin RC = ch2-A
Nimikkeistö
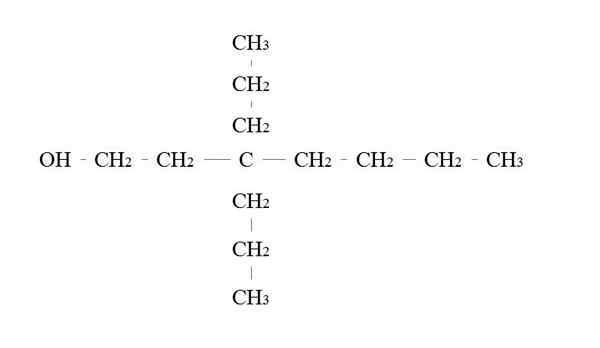 Ensisijainen alkoholimerkki. Lähde: Gabriel Bolívar.
Ensisijainen alkoholimerkki. Lähde: Gabriel Bolívar. Ensisijaisen alkoholin nimeämissäännöt ovat samat kuin muille alkoholille; Poikkeuksella, että joskus ei ole tarpeen luetella OH: n kantaja.
Yläkuvassa on seitsemän hiiliketju. Hiili, joka on kytketty OH: hon. Sen IUPAC-nimi on siis: 3.3-Dietilheptanol.
Huomaa, että tämä on esimerkki erittäin haarautuneesta primaarisesta alkoholista.
Esimerkit
Lopuksi, jotkut ensisijaiset alkoholit mainitaan niiden perinteisen ja systemaattisen nimikkeistön mukaan:
-Metyyli, ch3vai niin
-Etyyli, ch3CH2vai niin
-N-propyyli, ch3CH2CH2vai niin
-N-heksyyli, ch3CH2CH2CH2CH2CH2vai niin
Nämä ovat johdettu lineaarisista alkaaneista. Muita esimerkkejä ovat:
-2-fenylyletanol, c6H5CH2CH2Voi (c6H5 = bentseenirengas)
-2-propen-1-OC (allilic alkoholi), CHO2= CHCH2vai niin
-1,2-tadiol, ch2Ojamainen2vai niin
-2-kloorietanoli (etyyleklorihydriini), clch2CH2vai niin
-2-buten-1-OL (krotilic alkoholi), ch3Ch = chch2vai niin
Viitteet
- Morrison, r.T. Ja Boyd, R. N. (1987). Orgaaninen kemia. (5ta Painos). Addison-Wesley Iberoamericana
- Carey, f. -Lla. (2008). Orgaaninen kemia. (6ta Painos). McGraw-Hill, Intermerica, toimittajat S.-Lla.
- Mel -tiede. (2019). Kuinka primaaristen alkoholien hapettuminen tapahtuu. Toipunut: Melscience.com
- Kuninkaallinen kemian yhdistys. (2019). Määritelmä: Ensisijaiset alkoholit. Palautettu: RSC.org
- Chriss E. McDonald. (2000). Primaaristen alkoholien hapettuminen estereille: kolme liittyvää tutkintakoketta. J -. Kemia. Koulutus., 2000, 77 (6), s. 750. Doi: 10.1021/ED077P750
- « Aktiinin ominaisuudet, rakenne, filamentit, funktio
- Diamagnetismimateriaalit, sovellukset, esimerkit »

