Aktiinin ominaisuudet, rakenne, filamentit, funktio
- 629
- 117
- Juan Breitenberg V
Se Aktiini Se on sytosolinen proteiini, joka muodostaa mikrofilamentit. Eukaryooteissa aktiini on yksi runsaimmista proteiineista. Esimerkiksi se edustaa 10% painon mukaan kokonaisproteiinista lihassoluissa; ja välillä 1 -5% proteiinista ei -lihassoluissa.
Tämä proteiini, välituotteiden ja mikrotubulusten vieressä, muodostaa sytoskeletonin, jonka päätoiminta on solun liikkuvuus, solun muodon ylläpitäminen, solujen jakautuminen ja organelien liikkuminen kasveissa, sienissä ja eläimissä.
 Lähde: sarkomeeri.SVG: David Richfield (Slashme-käyttäjä) Johdannainen työ: Rtama [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]
Lähde: sarkomeeri.SVG: David Richfield (Slashme-käyttäjä) Johdannainen työ: Rtama [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]] Aktiinisytoskeleiden isoformit.
Evoluutio -näkökulmasta aktiini on erittäin säilynyt proteiini. Eri lajeissa on noin 90% sekvenssihomologiaa. Yksisoluisissa organismeissa yksi geeni koodaa aktiinia Isaform. Monisoluisissa organismeissa eri geenit koodaavat useita aktiini -isomejä.
Aktiini yhdessä myosiinin kanssa olivat ratkaisevia rakenteita eukaryoottisten organismien evoluutio tulevaisuudessa ja niiden monipuolistaminen, koska ne sallivat liikkeen muiden rakenteiden, kuten flagella ja silia, puuttuessa ilman.
[TOC]
Rakenne: Aktiinifilamentit
Aktiini on yksi polypeptidiketjun globaali proteiini. Lihaksessa aktiinin molekyylimassa on noin 42 kDa.
Tällä proteiinilla on kaksi domeenia. Jokaisessa on kaksi aliverkkotunnusta ja rako verkkotunnusten välillä. ATP-MG+2 Liittyy rakoon. Amino- ja karboksiliterminaalit kokoontuvat aliverkkotunnukseen 1.
Actina g ja Actina f
Aktiinimuotoja on kaksi: Actin -monomeeri, nimeltään Actina g; ja rihmeinen polymeeri, joka koostuu aktiini -g -monomeereistä, nimeltään Actina F. Aktiinifilamenteilla, joita havaitaan elektronisella mikroskopialla, on kapeat ja leveät alueet, vastaavasti 7 nm ja 9 nm.
Koko filamentin ajan aktiinimonomeerit muodostavat kaksinkertaisen kierteen, joka on puristettu. Koko filamentin toistuva yksikkö koostuu 13 potkurista ja 28 aktiinimonomeeristä, ja sen etäisyys on 72 nm.
Aktiinihlantalla on kaksi päätä. Yksi muodostaa rako, joka yhdistää ATP-MG: n+2, joka sijaitsee samaan suuntaan kaikissa filamentin aktiinimonomeereissä, joita kutsutaan päähän (-); Ja toinen pää on päinvastainen, nimeltään pää (+). Siksi sanotaan, että aktiinihlantalla on polaarisuus.
Monta kertaa nämä komponentit tunnetaan mikrofilamenteina, koska ne ovat sytoskeleton komponentteja, jotka ovat vähemmän halkaisijaltaan.
Mistä löydämme aktiinin?
Aktiini on erittäin yleinen proteiini eukaryoottisissa organismeissa. Kaikista soluproteiineista aktiini edustaa noin 5–10% - solutyypistä riippuen. Esimerkiksi maksassa jokainen sen muodostavista soluista on melkein viisi.108 Aktiinimolekyylit.
Ominaisuudet
Aktiinin, monomeerin ja filamentin kaksi muotoa löytyy jatkuvasti dynaamisesta tasapainosta polymeroinnin ja depolymeerien välillä. Yleensä tästä ilmiöstä on kolme ominaisuutta:
1) Aktiinifilamentit ovat tyypillisiä eukaryoottisten solujen lihaskudoksen ja sytoskeleton rakenteelle.
Voi palvella sinua: merkittävimpien lipidien 10 ominaisuutta2) Polymerointi ja depolimerisaatio on dynaaminen prosessi, jota säädetään. Missä G-ATP-MG-aktiinimonomeerien polymerointi tai aggregaatio+2 Se tapahtuu molemmissa päissä. Että tämä prosessi tapahtuu riippuu väliaineen ja säätelyproteiinien olosuhteista.
3) Palkkien ja retikien muodostuminen, jotka muodostavat aktiinin sytoskeleton, antaa voiman solujen liikkuvuuteen. Tämä riippuu proteiineista, jotka osallistuvat ristisidosten muodostumiseen.
Funktiot
Lihassupistus
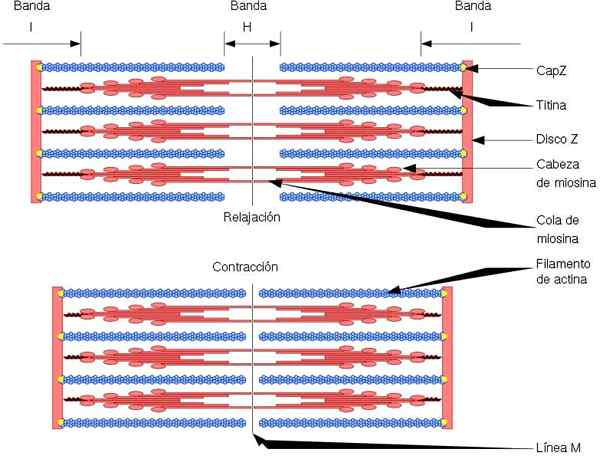
Luurankojen lihaksen funktionaalinen ja rakenneyksikkö on sarkomeeri, jolla on kahden tyyppisiä filamentteja: ohuet filamentit, jotka on muodostettu aktiinilla, ja paksut filamentit, jotka on muodostettu myosiinia. Molemmat filamentit on järjestetty vuorotellen, tarkalla geometrisellä tavalla. Salli lihasten supistuminen.
Ohut filamentit ankkuroituvat alueille, joita kutsutaan levyiksi z. Tämä alue koostuu kuituverkosta, jossa CAPZ -proteiini sijaitsee ja johon aktiinifilamenttien päät (+) ankkuroituvat. Tämä ankkuri estää lopun depolerisaation (+).
Toisaalta, aktiinifilamenttien päissä (-), tropomoduliini sijaitsee ja suojaa niitä depolymeereiltä. Aktiinin lisäksi ohuilla filamenteilla on tropomiosiini ja troponiini, joilla on aktomosiinin vuorovaikutusten hallinta.
Kuinka lihasten supistuminen tapahtuu?
Lihasten supistumisen aikana paksut filamentit tekevät kääntöliikkeistä ja vetävät ohuet filamentit sarkomeerin keskustaa kohti. Tämä tuottaa paksujen ja ohuiden kuitujen liukumisen.
Siten paksujen ja ohuiden filamenttien pituus pysyy vakiona, mutta lisää molempien filamenttien päällekkäisyyttä. Sarkomeerin pituus pienenee ohuiden filamenttien ankkuroimalla Z -levyihin.
Kuinka lihasten supistuminen pysähtyy?
ATP on solun energiavaluutta. Siksi se on melkein aina saatavana elävissä lihaskudoksissa. Edellä esitetyn on oltava mekanismeja, jotka sallivat lihasten rentoutumisen ja supistumisten pidättämisen.
Kahdella proteiinilla, nimeltään tropomiosiini ja troponiini, on perustavanlaatuinen rooli tässä ilmiössä. Nämä toimivat yhdessä estämään myosiinin unionin sivustot (estäen siten heidän liitonsa aktiinin kanssa). Seurauksena on, että lihakset rentoutuvat.
Päinvastoin, kun eläin kuolee, kokee ilmiön, joka tunnetaan nimellä Mortis Tureor. Kehon kovettumisesta vastuussa oleva henkilö on myosiinin ja aktiinin vuorovaikutuksen estäminen pian eläimen kuoleman jälkeen.
Yksi tämän ilmiön seurauksista on ATP: n tarve kahden proteiinimolekyylin vapauttamiseksi. Loogisesti, ATP: n saatavuutta kuolleissa kankaissa ei ole, ja tätä julkaisua ei voi tapahtua.
Muun tyyppiset liikkeet
Sama mekanismi, jota kuvaamme (myöhemmin syventämme liikkeen taustalla olevaa mekanismia) ei ole rajoitettu eläinten lihasten supistuksiin. Hän on vastuussa ameboidaalisista liikkeistä, joita havaitsemme Amoebasissa ja joissain siirtomaa -muotissa.
Samoin levä- ja maan kasveissa havaitsemamme sytoplasmisen liikkeen johtavat samanlaiset mekanismit.
Aktiinifilamentin polymeroinnin ja depolymeroinnin säätely
Sileän lihaskudoksen ja solujen supistuminen tuottaa aktiinin F kasvun ja aktiinin G väheneminen. Aktiinipolymerointi tapahtuu kolmessa vaiheessa: 1) ydin, hidas vaihe; 2) pidennys, nopea askel; ja 3) vakaa tila. Polymeroinnin nopeus on yhtä suuri kuin depolymerointinopeus.
Voi palvella sinua: Fixist -teoria: Konsepti, postulaatit ja kirjoittajatAktiinihahlan kasvaa nopeammin lopussa (+) kuin loppu (-). Pidentymisnopeus on verrannollinen aktiinimonomeerien pitoisuuteen tasapainossa aktiinifilamenttien kanssa, joita kutsutaan kriittiseksi konsentraatioksi (CC).
CC: n (+) CC on 0,1 um ja päähän (-) 0,8 um. Tämä tarkoittaa, että aktiinimonomeerien pitoisuus on 8 kertaa vähemmän pään polymeroimiseksi (+).
Aktiinipolymerointia säätelevät pääasiassa beeta4 -huijaukset (TB4). Tämä proteiini yhdistää aktiinin g ja säilyttää sen, estäen polymerice. Kun taas propylin stimuloi aktiinipolymerointia. Profiili sitoutuu aktiinimonomeereihin, jotka helpottavat polymerointia lopulla (+), aktiini-TB4-kompleksin dissosiaatiolla.
Muut tekijät, kuten ioni kasvaa (NA+, K -k -+ tai mg+2) suosia filamenttien muodostumista.
Aktiinisytoskeleton muodostuminen
Aktiinisytoskeleton muodostuminen vaatii aktiinifilamenttien välisten ristisidosten laatimista. Nämä linkit muodostavat proteiineja, joiden kohokohdat ovat: niillä on aktiinin unionin domeeneja; Monilla on homologiset domeenit kalponiiniin; ja jokainen proteiinityyppi ekspressoituu tietyntyyppisissä soluissa.
Philopodesissa ja stressikuituissa fassiini ja Philamine tekevät aktiinifilamenttien välisiä sidoksia. Nämä proteiinit tekevät vastaavasti aktiinifilamenteista yhdensuuntaisesti tai niillä on erilaiset kulmat. Siksi aktiinifilamentit määrittelevät solun muodon.
Solualue, jolla on suurin aktiinifilamentit, sijaitsee lähellä plasmamembraania. Tätä aluetta kutsutaan aivokuoreksi. Aivokuoren sytoskeleton on järjestetty eri muodoissa solutyypistä riippuen, ja se yhdistää plasmamembraanin kiinnittämällä proteiineja.
Jotkut parhaiten kuvatuista sytoskeletoista ovat lihassolut, verihiutaleet, epiteelisolut ja punasolut. Esimerkiksi lihassoluissa dystrofiinin kiinnitysproteiini yhdistää aktiinifilamentit kalvon kattavaan glykoproottiseen kompleksiin. Tämä kompleksi sitoutuu solunulkoisiin matriisiproteiineihin.
Aktiinimiosiini-vuorovaikutusmalli
Rayment -johtamat tutkijat ehdottivat neljävaiheista mallia aktiinin ja myosiinin vuorovaikutuksen selittämiseksi. Ensimmäinen askel tapahtuu ATP: n liiton kanssa myosiinin päähän. Tämä liitto tuottaa konformaatiomuutoksen proteiinissa, vapauttaen sen aktiinista pienessä filamentissa.
Sitten ATP hydrolysoidaan ADP: lle vapauttaen epäorgaanisen fosfaatin. Myosiinimolekyyli on ankkuroitu uuteen aktiini -alayksikköön, mikä tuottaa korkean energian tilan.
Epäorgaanisen fosfaatin vapautuminen tuo mukanaan myosiinin muutoksen, palaamalla alkuperäiseen konformaatioon ja pienten filamenttien liikkumiseen paksujen filamenttien suhteen paksujen filamenttien suhteen suhteessa paksuihin filamenteihin nähden. Tämä liike aiheuttaa sarkomeerin kahden päähän liikkumisen, lähestyen heitä.
Viimeinen vaihe sisältää ADP: n vapautumisen. Tässä vaiheessa myosiinin pää on vapaa ja voi liittyä uuteen ATP -molekyyliin.
Se voi palvella sinua: biologia: historia, mitä tutkimuksia, haaroita, emäksiäAktiinipolymeroinnin ohjaama soluliike
Rehtorin liikkuvuus on eräänlainen solujen liikkuvuus. Tämän tyyppisen liikkuvuuden vaiheet ovat: substraatin tarttumisen johtavan akselin projektio; tarttuvuus substraattiin; takaosan vetäytyminen; ja Des-Adheesio.
Johtavan akselin projektio vaatii proteiinien osallistumisen, jotka osallistuvat aktiinifilamenttien polymerointiin ja depolimerointiin. Johtava akseli sijaitsee solun aivokuoressa, nimeltään lamellipodio. Akselin projektiovaiheet ovat:
- Reseptorin aktivointi solunulkoisella signaalilla.
- Aktiivisten GTPASA: ien ja 4,5-bishoposfaattifosfoinositolien muodostuminen (PIP2-A.
- Wasp/Scar- ja ARP2/3 -proteiinin aktivaatio, jotka sitoutuvat aktiinimonomeereihin muodostamaan aktiinifilamentteja seuraamuksia.
- Aktiinifilamenttien nopea kasvu, lopulta koristeltu myosiinilla, haarautumisella. Kalvon työntövoima tuotetaan eteenpäin.
- Pitkityksen huipentuma, joka on valmistettu peittoproteiinien tuottama.
- ATP -hydrolyysi, joka on kiinnitetty aktiiniin vanhimpiin filamenteihin.
- Adf/cofilina edistämien filamenttien aktiini-ad-filamenttien depolimerointi.
- ADP-vaihto ATP: llä, jota katalysoidaan profylainilla, aiheuttaen aktiinia G-ATP: n valmiina aloittamaan pidentämisen seuraukset.
Aktiiniin liittyviä sairauksia
Lihassurkastumatauti
Lihasdystrofia on rappeuttava luuston lihaksen sairaus. Se on peritty toistuvasti ja on kytketty X -kromosomiin. Pääasiassa miehille, joilla on korkea taajuus väestössä (yksi kolmesta.500 miestä). Näiden miesten äidit ovat oireettomia heterotsygoottisia, ja heillä ei ole perheen historiaa.
Lihasdystrofian, Duchennen ja Beckerin, ja molemmat johtuvat dystrofiinigeenin puutteista kahta muotoa. Nämä viat koostuvat deleetioista, jotka eliminoivat aksonit.
Dystrofiini on proteiini (427 kDa), joka muodostaa ristisidokset aktiinifilamenttien välillä. Sillä on unionin hallitseminen aktiinille N-terminaalissa ja membraaniliiton hallitseminen C-terminaalissa. Molempien domeenien välillä on kolmas putkimainen domeeni, jonka muodostaa 24 tandemin toistoa.
Lihaskuoren retikulumissa dystrofiini osallistuu aktiinifilamenttien liitokseen plasmamembraaniin glykoproottisen kompleksin kautta. Tämä kompleksi sitoutuu myös solunulkoisiin matriisiproteiineihin.
Potilailla, joilla ei ole funktionaalista dystrofiinia, Duchennen lihasdystrofialla, aivokuoren sytoskeleton ei tue plasmamembraania. Tämän seurauksena plasmamembraania vaurioituu toistuvien lihasten supistumisten stressi.
Viitteet
- Devlin, t.M. 2000. Biokemia. Toimitusverkko, Barcelona.
- S. S.J -., ja Zhang, W. 2008. Aktiinisytoskeletaalinen dynaaminen sileässä lihaksessa: uusi paradigma sileän lihaksen supistumisen säätelemiseksi. Am J Physiol Cell Physiol, 295: C576-C587.
- Loodish, h., Berk, a., Zipurski, S.Lens., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Solu- ja molekyylibiologia. Toimitus Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Meksiko, Sāo Paulo.
- Nelson, D. Lens., Cox, m. M. 2008. Biokemian lehninger-periaatteet. W -.H. Freeman, New York.
- Pfaendtner, J., Ristiltä ja. M., Voth, G. 2010. Aktiinifilamentin uudelleenmuodostus aktiinin depolymerointikertoimella/kofiliini. PNAS, 107: 7299-7304.
- Pollard, t.D -d., Borisy, g.G. 2003. Solun liikkuvuus, joka johtuu aktiini täyteaineiden kokoonpanosta ja purkamisesta. Cell, 112: 453-465.
- « Apolipoproteiinit mitä ovat, toiminnot, tyypit
- Primaarinen alkoholirakenne, ominaisuudet, nimikkeistö, esimerkit »

