Alfa Amilasa -ominaisuudet, rakenne, toiminnot
- 4547
- 1128
- Louis Moen
Se Alfa Amilasa (α-amylaasi) on Endo Amilasas -ryhmän amiloliittinen entsyymi, joka on vastuussa α-1,4-sidosten hydrolyysistä glukoositähteiden välillä, jotka muodostavat erityyppiset hiilihydraatit luonnossa.
Systemaattisesti tunnetaan systemaattisesti nimellä α-1,4-glukaani. Esimerkiksi ihmisillä syljen ja haiman erittämät amylaasit ovat α-amylaasien tyyppiä.
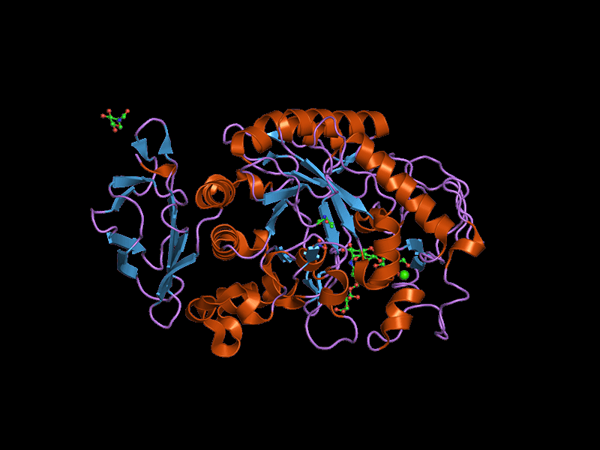
 Alfa Amilasa -eläimen C-terminaalinen alueen rakenne (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan Bioinformatics-instituutissa [julkinen alue] Wikimedia Commonsin kautta) Wikimedia Commonsin kautta)
Alfa Amilasa -eläimen C-terminaalinen alueen rakenne (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan Bioinformatics-instituutissa [julkinen alue] Wikimedia Commonsin kautta) Wikimedia Commonsin kautta) Kuhn, vuonna 1925, oli ensimmäinen, joka kolikon termi "α-amylaasi" perustuen siihen, että näitä entsyymejä katalysoivat hydrolyysituotteet ovat konfiguraatiot a. Myöhemmin, vuonna 1968, määritettiin, että nämä toimivat mieluiten lineaarisissa ja ei -haarautuneissa rakenteellisissa konfiguraatioalustaissa.
Kuten muutkin amiloliittiset entsyymit, a-amylaasi on vastuussa tärkkelyksen ja muiden vastaavien molekyylien, kuten glykogeenin, hydrolyysistä, mikä tuottaa pienemmät polymeerit, jotka koostuvat toistuvista glukoosin yksiköistä.
Niiden fysiologisten toimintojen lisäksi, joita tällä entsyymillä on eläimissä, kasveissa ja mikro-organismeissa, jotka ilmentävät sitä, α-amylaasia yhdessä muiden olemassa olevien amylaasien muiden luokkien kanssa edustavat 25% teollisuuden ja biotekniikan tarkoituksiin käytetyistä entsyymeistä Nykyisiä markkinoita.
Monet sienilajit ja bakteerit ovat tärkein lähde a-amylaasien hankkimiseksi, joita käytetään useammin teollisuudessa ja tieteellisessä kokeessa. Tämä johtuu pääasiassa sen monipuolisuudesta, helpon hankkimisesta, yksinkertaisesta hallinnasta ja tuotantoon liittyvät alhaiset kustannukset.
[TOC]
Ominaisuudet
Luonnossa löydetyillä α-amylaaseilla voi olla optimaaliset pH-alueet, joiden toiminta on hyvin erilainen pH; Esimerkiksi optimaalinen α-amylaasien eläimille ja kasvi on välillä 5.5 ja 8.0 pH -yksikköä, mutta joillakin bakteereilla ja sienillä on enemmän alkalisia entsyymejä ja enemmän happoja.
Voi palvella sinua: fylogenySylissä ja nisäkkäiden haimassa olevat entsyymit toimivat paremmin pH: n lähellä 7 (neutraali) lisäksi, ne vaativat kloridi -ioneja maksimaalisen entsymaattisen aktiivisuuden saavuttamiseksi ja kykenevät liittymään kaksiarvoisia kalsiumioneja.
Molemmat eläimet, sylki- että haiman entsyymit tuottavat organismeissa riippumattomien mekanismien avulla, joihin liittyy spesifisiä soluja ja rauhasia ja jotka eivät todennäköisesti liity entsyymeihin.
Sekä pH että optimaalinen lämpötila näiden entsyymien toiminnalle riippuu suuresti otetun organismin fysiologiasta, koska on olemassa ääriliikkeitä mikro -organismeja, jotka kasvavat erityisissä olosuhteissa näiden ja monien muiden parametrien suhteen suhteessa näihin ja moniin muihin parametreihin nähden.
Lopuksi, sen aktiivisuuden säätelyn suhteen a-amylaasiryhmän entsyymien välinen ominaisuus on, että raskasmetalli-ionit voivat estää nämä, kuten muutkin amylaasit, kuten muutkin amylaasit, kuten muutkin amylaasit, kupari, hopea ja lyijy.
Rakenne
Α-amylaasi on monidominiumin entsyymi, jonka eläimissä ja kasveissa on likimääräinen molekyylipaino 50 kDa ja eri kirjoittajat ovat yhtä mieltä siitä, että tähän glykolikohydrolesaseen perheeseen kuuluvat entsyymit ovat entsyymejä, joilla on yli kymmenen rakenteellista domeenia.
Keskusdomeeni tai katalyyttinen domeeni on hyvin säilynyt ja tunnetaan nimellä domeeni A, joka koostuu 8 β-levittyneen arkin symmetrisestä laskosta, joka on järjestetty "tynnyrin" muodossa, joita ympäröivät 8 alfa-salia, joten löydät myös Kirjallisuudessa kuinka (β/α) 8 tai "Tim" -tyyppinen tynnyri.
On tärkeää huomata, että domeenin A β-arkkien C-terminaalisessa päässä ovat säilyneet aminohappojätteet, jotka osallistuvat katalyysiin ja substraatin risteykseen ja että tämä domeeni sijaitsee N-terminaalisella alueella proteiini.
Se voi palvella sinua: Perun meren eläimistö ja kasvistoToinen näiden entsyymien tutkituimmista domeeneista on ns. Ding B, joka erottuu β-verkon laminaa ja domeenin A alfa-numeron 3 potkurin välillä. Tällä on perustavanlaatuinen rooli substraatin ja kalliiden kalsiumin liitossa.
Lisädomeeneja on kuvattu α-amytyylientsyymeille, kuten domeenit C, D, F, G, H ja I, jotka sijaitsevat domeenin A edessä tai takana ja joiden toiminnot eivät tunneta tarkalleen ja riippuvat organismista, joka sitä tutkitaan.
mikro-organismien α-amylaasit
A-amylaasien molekyylipaino riippuu, samoin kuin muut biokemialliset ja rakenteelliset ominaisuudet, jotka tutkitaan. Siten monien sienten ja bakteerien α-amylaasien painot ovat jopa 10 kDa ja jopa 210 kDa.
Joidenkin näiden mikrobien entsyymien korkea molekyylipaino liittyy usein glykosilaation läsnäoloon, vaikka proteiinin glykosylaatio bakteereissa on melko harvinaista.
Funktiot
Eläimissä α-amylaasit ovat vastuussa tärkkelyksen ja glykogeenin aineenvaihdunnan ensimmäisistä vaiheista, koska ne ovat vastuussa niiden hydrolyysistä pienempiin fragmentteihin. Niiden tuotannon tuotannosta vastaavan maha -suolikanavan elimet ovat haima ja sylkirauhaset.
Monien nisäkkäiden sylkirauhasien tuottamien α-amylaasien tuotannon ilmeisen aineenvaihdunnan toiminnan lisäksi monet kirjoittajat pitävät tärkeänä "psykobiologisena" stressimerkinnän stressissä keskushermoston stressin tärkeänä "psykobiologisena" stressimarkkerina.
Sillä on myös toissijaisia toimintoja suun terveydessä, koska sen aktiivisuus toimii suun kautta otettavien bakteerien eliminoinnissa ja sen tarttumisen estämisessä oraalisiin pintoihin.
Se voi palvella sinua: Sympatrinen spesifikaatio: Konsepti, ominaisuudet ja esimerkitPäätoiminto kasveissa
Kasveissa α-amylaasilla on ensisijainen rooli siementen itävyydessä, koska ne ovat entsyymejä, jotka hydrolysoivat endospermissä läsnä olevan tärkkelyn, joka ravitsee alkion sisällä, prosessiin, jota olennaisesti hallitsee gibbereliini, fytorni.
Teollisuussovellus
Α-amylaasien perheeseen kuuluvat entsyymit ovat useita sovelluksia monissa eri tilanteissa: teollisuus, tieteellinen ja bioteknologinen jne.
Suurilla tärkkelysprosessointiteollisuuksilla α-amylaaseja käytetään yleisesti glukoosin ja fruktoosin tuotantoon, samoin kuin leivän tuottamiseen parannetuilla tekstuureilla ja uskollisemmalla kapasiteetilla.
Bioteknologisella kentällä on paljon kiinnostusta kaupallisesti käytettyjen entsyymien parantamisesta niiden vakauden ja suorituskyvyn parantamiseksi eri olosuhteissa.
Viitteet
- Aiyer, P. V. (2005). Amylaasit ja niiden sovellukset. Afrikkalainen bioteknologian lehti, 4(13), 1525-1529.
- Bernfeld, P. (1960). Amylaasit, a ja b. Sisään Hiilihydraattimetabolian entsyymit (Vol. Minä, pp. 149-158).
- Granger, D. -Lla., Kivighan, K. T., M., Gordis, E. B -., & Stud, L. R -. (2007). Sylki a-andlaasi biopohjaisessa tutkimuksessa. Viimeaikainen kehitys ja sovellukset. Lupa. N.JA. Akutti. Sci., 1098, 122-144.
- Monteiro, P., & Oliveira, P. (2010). Mikrobien A-andlase -sovelluksen soveltaminen teollisuudessa- katsaus. Brasilian Journal of Microbiology, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, k. R -. S. S. (2003). Yleiskatsaus mikrobi-a-love-perheestä. Afrikkalainen bioteknologian lehti, 2(12), 645-648.
- Suola, w., & Shenker, S. (1976). Amylaasi- sen kliininen merkitys: Katsaus kirjallisuuteen. Lääke, 55(4), 269-289.
- Svensson, b., & MacGregor ja. -Lla. (2001). Sekvenssin ja rakenteen suhde spesifisyyteen A-amylaasi-entsyymien perheessä. Biochimica et Biophysica Acta, 1546, 1-20.
- Thoma, J. -Lla., Spradlin, J. JA., & Dygert, S. (1925). Kasvi- ja eläinten amylaasit. Lupa. Kemia., 1, 115-189.
- « Reniinirakenne, tuotanto, eritys, toiminnot
- Urie Bronfenbrenner Elämäkerta, ekologinen malli ja panokset »

