Anhydridit

- 4913
- 102
- Ronald Reilly
Mitä anhydridit ovat?
Se Anhydridit Ne ovat kemiallisia yhdisteitä, jotka ovat peräisin kahden molekyylin liitoksesta vapauttamalla vettä. Siten sitä voidaan pitää alkuperäisten aineiden kuivumisena; Vaikka se ei ole tarkalleen totta.
Orgaanisessa ja epäorgaanisessa kemiassa ne mainitaan, ja molemmissa oksissa heidän ymmärryksensä eroaa huomattavassa määrin. Esimerkiksi epäorgaanisessa kemiassa pidetään emäksisiä ja happosoksideja, kuten niiden hydroksidien ja happojen anhydrien, koska entinen reagoi veden kanssa toisen muodostamiseksi.
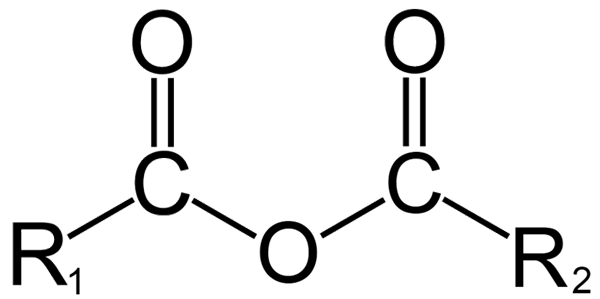 Anhydridien yleinen rakenne. Lähde: DremmetBrownie [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)], Wikimedia Commons
Anhydridien yleinen rakenne. Lähde: DremmetBrownie [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)], Wikimedia Commons Tässä voidaan luoda sekaannus termien 'vedettömien' ja 'anhydrido' välillä. Yleensä vedetön viittaa yhdisteeseen, johon se on kuivunut ilman muutoksia sen kemiallisessa luonteessa (ei ole reaktiota); Anhydridin kanssa tapahtuu kemiallinen muutos, joka heijastuu molekyylirakenteessa.
Jos verrataan vastaavia hydroksideja ja happoja (tai anhydridejä), havaitaan, että reaktio oli olemassa. Toisaalta jotkut oksidit tai suolat voivat olla hydratoituneita, menettää vettä ja edelleen olla samat yhdisteet; Mutta ilman vettä, eli anhydrot.
Orgaanisessa kemiassa toisaalta se, mitä anhydridi ymmärtää, on alkuperäinen määritelmä. Esimerkiksi yksi tunnetuimmista anhydrideistä on karboksyylihapoista johdettuja (ylivoimainen kuva). Nämä koostuvat kahden asyyliryhmän (-rco) liitosta happiatomin kautta.
Yleisessä rakenteessa R on ilmoitettu1 Asyyliryhmälle ja r2 Toiselle ACILO -ryhmälle. Koska r1 ja r2 Ne ovat erilaisia, tulevat eri karboksyylihapoista ja sitten se on epäsymmetrinen happoanhydridi. Kun molemmat substituentit r (ovatko aromaattiset) samat, symmetrisen happoanhydridin tapauksessa puhuu siinä tapauksessa.
Kahden karboksyylihapon kytkemisen yhteydessä vettä voi muodostua vettä, samoin kuin muut yhdisteet. Kaikki riippuu näiden happojen rakenteesta.
Anhydridiominaisuudet
Anhydridien ominaisuudet riippuvat siitä, mihin viittaa. Lähes kaikilla on yhteistä, että he reagoivat veden kanssa. Epäorgaanisten SO -nimisten perusanhydridien osalta monet niistä ovat jopa liukenemattomia veteen (MGO), joten tämä lausunto keskittyy karboksyylihappojen anhydrideihin.
Fuusio- ja kiehumispisteet putoavat molekyylirakenteeseen ja molekyylien välisiin vuorovaikutuksiin (RCO)2Tai tämä on näiden orgaanisten yhdisteiden yleinen kemiallinen kaava.
Jos (RCO) molekyylimassa2Tai se on alhainen, se on todennäköisesti väritön neste huoneenlämpötilassa ja paineessa. Esimerkiksi etikkahydridi (tai ehydridge3Co)2Tai se on nestemäinen ja tärkein teollisuuden merkitys, sen tuotanto on erittäin laaja.
Etikkahappoanhydridin ja veden välistä reaktiota edustaa seuraava kemiallinen yhtälö:
(CH3Co)2Tai + h2O => 2CH3Haittaa
Huomaa, että kun vesimolekyyli lisätään, kaksi etikkahapon molekyyliä vapautuu. Käänteinen reaktio ei kuitenkaan voi tapahtua etikkahapolle:
Voi palvella sinua: Nestemäistä höyryn tasapainoa2CH3Cooh => (CHO3Co)2Tai + h2Tai (ei tapahdu)
On välttämätöntä turvautua toiseen synteettiseen reittiin. Dikarboksyylihapot toisaalta voivat tehdä niin kuumentamalla; Mutta se selitetään seuraavassa osassa.
Kemialliset reaktiot
Hydrolyysi
Yksi anhydridien yksinkertaisimmista reaktioista on niiden hydrolyysi, joka on juuri osoitettu etikkahydridille. Tämän esimerkin lisäksi on rikkihappohydridiä:
H2S2JOMPIKUMPI7 + H2Tai 2h2Sw4
Täällä sinulla on epäorgaaninen happoanhydridi. Huomaa, että H: lle2S2JOMPIKUMPI7 (kutsutaan myös disulfuriinihapoksi), reaktio on palautuva, joten kuumentaminen H2Sw4 konsentraatti johtaa sen anhydridin muodostumiseen. Jos toisaalta se on laimennettu H -liuos2Sw4, Se julkaistaan niin3, Rikkihappoanhydridi.
Esteröinti
Happihappoanhydridit reagoivat alkoholien kanssa, joiden pyridiini on keskellä, aiheuttaen esteriä ja karboksyylihappoa. Esimerkiksi etikkahappoanhydridin ja etanolin välistä reaktiota otetaan huomioon:
(CH3Co)2Tai + ch3CH2Voi => Cho3Yhteistyö2CH2CH3 + CH3Haittaa
Muodostaen siten etyyli -etaanesterin, ch3Yhteistyö2CH2CH3, ja etaanihappo (etikkahappo).
Käytännössä Aquilus -ryhmän hydroksyyliryhmän vedyn korvaaminen:
R -1-Voi => r1-OCOR2
(CH: n tapauksessa3Co)2Tai acilo -ryhmäsi on -coch3. Siksi sanotaan, että OH -ryhmä on käynnissä. Acilation ja esteröinti eivät kuitenkaan ole vaihdettavia käsitteitä; Acilation voi tapahtua suoraan aromaattisessa renkaassa, joka tunnetaan nimellä Friedel-Crafts Acilation Name.
Siten alkoholit happohanhydridien läsnä ollessa esteröidaan soveltamalla.
Toisaalta vain yksi kahdesta happaryhmästä reagoi alkoholin kanssa, toinen pysyy vedyn kanssa, joka muodostaa karboksyylihappoa; että (CHO3Co)2Tai se on etanoehapoa.
Huolenaihe
Happihappoanhydridit reagoivat ammoniakin tai amiinien kanssa (primaarinen ja sekundaarinen), jotta saadaan aikaan amideja. Reaktio on hyvin samanlainen kuin hiljattain kuvattu esteröinti, mutta ROH korvataan amiinilla; Esimerkiksi toissijainen amina, r2Nh.
Jälleen reaktio (ch3Co)2Tai ja dietyyliamiini, et2NH:
(CH3Co)2O + 2et2Nh => ch3Jatkoa2 + CH3Kujertaa- +Nh2ET -ET -2
Ja diethilaketamidi muodostetaan, Cho3Jatkoa2, ja karboksyloitu ammoniumsuola, Cho3Kujertaa- +Nh2ET -ET -2.
Vaikka yhtälö voi tuntua hiukan vaikealta ymmärtää, riittää tarkkailemaan, kuinka ryhmä -kärjessä3 Vaihda ET: n H2NH Amidan muodostamiseksi:
ET -ET -2Nh => et2Ncoch3
Reaktio on edelleen acilation. Kaikki on yhteenveto siinä sanassa; Tällä kertaa Amina kärsii pilaantumisesta eikä alkoholista.
Kuinka anhydridit ovat?
Epäorgaaniset anhydridit muodostuvat reagoimalla elementti happea. Siten, jos elementti on metallinen, muodostuu emäksinen metallioksidi; Ja jos se on ei -metallista, muodostuu ei -metallista oksidi- tai happihappoanhydridiä.
Se voi palvella sinua: Clausius-Clapeyron yhtälö: Mihin se on, esimerkkejä, harjoituksiaOrgaanisten happoanhydridien osalta reaktio on toinen. Kaksi karboksyylihappoa ei voi liittyä suoraan veden vapauttamiseen ja hapanhappojen muodostamiseksi; Yhdisteen osallistuminen, jota ei ole vielä mainittu: asyylikloridi, RCOCL on välttämätön.
Karboksyylihappo reagoi happokloridin kanssa tuottaen vastaavan anhydridin ja vetykloridin:
R -1Cocl + R2Cooh => (r1Co) tai (cor2) + HCL
CH3Cocl + ch3Cooh => (CHO3Co)2O + HCl
A ch3 tulee asetyyliryhmästä, Cho3Yhdessä, ja toinen on jo läsnä etikkahapossa. Spesifisen happokloridin ja karboksyylihapon valinta voi aiheuttaa symmetrisen tai epäsymmetrisen happoanhydridin synteesiä.
Sykliset anhydridit
Toisin kuin muut karboksyylihapot, jotka vaativat happakloridia, dikarboksyylihappot voivat tiivistää vastaavassa hapopisteen. Tätä varten on tarpeen lämmittää ne H: n vapautumisen edistämiseksi2JOMPIKUMPI. Esimerkiksi ftaalihappoanhydridin muodostuminen on esitetty valohaposta.
 Fthaliset anhydridimuodostumat. Lähde: Jü [julkinen verkkotunnus], Wikimedia Commons
Fthaliset anhydridimuodostumat. Lähde: Jü [julkinen verkkotunnus], Wikimedia Commons Huomaa, kuinka viisikulmainen rengas on valmis, ja happi, joka yhdistää molemmat ryhmät C = O, on osa sitä; Tämä on syklinen anhydridi. Voidaan myös nähdä, että ftaalihappoanhydridi on symmetrinen anhydridi, koska niin paljon r1 kuten r2 Ne ovat identtisiä: aromaattinen rengas.
Kaikki dikarboksyylihapot eivät kykene muodostamaan anhydridiaan, koska kun niiden COOH -ryhmät ovat hyvin erillään, ne pakotetaan täyttämään yhä suuremmat renkaat. Suurin rengas, joka voidaan muodostaa.
Nimikkeistö
Kuinka anhydridit nimetään? Jättämättä syrjään epäorgaaniset, merkitykselliset oksidikysymykset, orgaanisten anhydridien nimet toistaiseksi riippuvat r: n identiteetistä1 ja r2; toisin sanoen sen asyyliryhmistä.
Jos nämä kaksi r ovat samat, se riittää korvaamaan sana 'happo' 'anhydridillä' vastaavassa karboksyylihapon nimessä. Ja jos päinvastoin, nämä kaksi r ovat erilaisia, ne on nimetty aakkosjärjestyksessä. Siksi tietääksesi kuinka kutsua sitä, sinun on ensin nähtävä, onko se symmetrinen vai epäsymmetrinen anhydridi.
CH3Co)2Tai se on symmetrinen, koska r1= R2 = Ch3. Se on peräisin etiasta tai etanoehaposta, joten sen nimi on edellisen selityksen seurauksena: etikka- tai etanoinen anhydridi. Sama tapahtuu juuri mainitun fthalic anhydridin kanssa.
Oletetaan, että sinulla on seuraava anhydridi:
CH3Co (O) -koki2CH2CH2CH2CH2CH3
Vasemmalla puolella oleva asetyyliryhmä tulee etikkahaposta ja oikealla heptaanihaposta. Tämän anhydridin nimeämiseksi sinun on nimitettävä sen R -ryhmät aakkosjärjestyksessä. Joten hänen nimensä on: heptanoinen etikkahydridi.
Sovellukset
Epäorgaanisilla hyydrideillä on loputtomia sovelluksia materiaalien, keramiikan, katalyyttien, sementtien, elektrodien, lannoitteiden jne. Synteesistä ja formulaatiosta jne., Kunnes maapallon kuoren päällyste tuhansilla rauta- ja alumiinimineraaleilla ja elävien organismien hengittämä hiilidioksidi.
Voi palvella sinua: Dekantointi: Konsepti, esimerkit ja tyypitNe edustavat lähtölähdettä, pistettä, jossa monet epäorgaanisessa synteesissä käytetyt yhdisteet ovat peräisin. Yksi tärkeimmistä anhydrideistä on hiilihiilinen, yhteistyö2. Se on yhdessä veden kanssa välttämätön fotosynteesille. Ja teollisuustasolla, niin3 Se on välttämätöntä, koska vastaajan rikkihappo saadaan siitä.
Ehkä anhydridi, jolla on enemmän sovelluksia ja jolla on (niin kauan kuin elämää), on yksi fosforihaposta: adenosiinitryposfaatti, joka tunnetaan paremmin nimellä ATP, läsnä DNA: ssa ja "energiavaluutan" aineenvaihdunnassa ".
Orgaaniset anhydridit
Happihappoanhydridit reagoivat asyloinnin läpi joko alkoholiin, muodostaen esterin, amiinin, aiheuttaen amidaa tai aromaattista rengasta.
Jokaista näistä yhdisteistä on miljoonia ja satoja tuhansia karboksyylihappovaihtoehtoja anhydridin valmistamiseksi; Siksi synteettiset mahdollisuudet kasvavat rajusti.
Siten yksi tärkeimmistä sovelluksista on sisällyttää happaryhmä yhdisteeseen, korvaavan yhden sen rakenteen atomista tai ryhmistä.
Jokaisella dioksidilla on erikseen omat sovelluksensa, mutta yleensä ne kaikki reagoivat samalla tavalla. Tästä syystä tämän tyyppisiä yhdisteitä käytetään modifioimaan polymeerirakenteita, jolloin luodaan uusia polymeerejä; Eli kopolymeerit, hartsit, pinnoitteet jne.
Esimerkiksi etikkahydridiä käytetään kaikkien selluloosan OH -ryhmien asettamiseen (alempi kuva). Tällä jokainen OH: n H korvataan asetyyliryhmällä, Coch3.
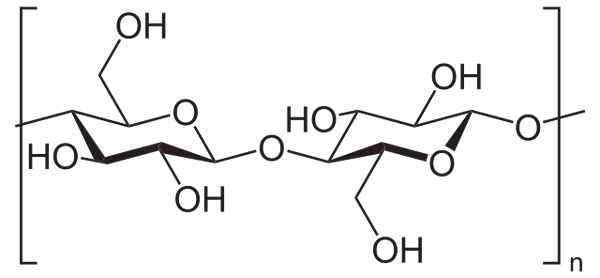 Selluloosa. Lähde: Neurotogers [julkinen alue], Wikimedia Commons
Selluloosa. Lähde: Neurotogers [julkinen alue], Wikimedia Commons Tällä tavoin saadaan selluloosa -asetaattipolymeeri. Sama reaktio voidaan luonnostella muiden polymeerirakenteiden kanssa NH -ryhmien kanssa2, Myös alttiita soveltuvuudelle.
Nämä sovilaatioreaktiot ovat hyödyllisiä myös lääkkeen synteesille, kuten aspiriini (happo asetyylisalisyyli).
Esimerkit
Niiden on osoitettu viimeistelemään joitain muita esimerkkejä orgaanisista anhydriista. Vaikka happeatomeja ei mainita niitä, ne voidaan korvata rikki, antaen rikkipohjaisia anhydridejä tai jopa fosforia.
-C6H5Kokki6H5: Bentsoic anhydridi. Ryhmä C6H5 edustaa bentseenirengasta. Sen hydrolyysi tuottaa kaksi bentsoehappoa.
-HCO (O) COH: Muodostaja anhydridi. Sen hydrolyysi tuottaa kaksi muurahaishappoa.
- C6H5Co (O) -koki2CH3: Propanoic bentsoic anhydridi. Sen hydrolyysi tuottaa bentsooisia ja propanihappoja.
-C6HyksitoistaKokki6Hyksitoista: Syklohexanocroboxyylicanight anhydrid. Toisin kuin aromaattiset renkaat, nämä ovat tyydyttyneitä ilman kaksoislinkkejä.
-CH3CH2CH2Co (O) -koki2CH3: Propanoic butanic anhydridi.
Suppinihydridi
 Suppinihydridi. Lähde: Ninjatacoshell [julkinen alue], Wikimedia Commons
Suppinihydridi. Lähde: Ninjatacoshell [julkinen alue], Wikimedia Commons Täällä on toinen syklinen, johdettu sucniinihapoista, dikarboksyylihappo. Huomaa, kuten kolme happiatomia pettävät tämän tyyppisen yhdisteen kemiallisen luonteen.
Anhydridi -manico on hyvin samanlainen kuin subininen, erolla, että Pentagonin pohjan muodostavien hiilihiilien välillä on kaksoissidos.
Glutaarinen anhydridi
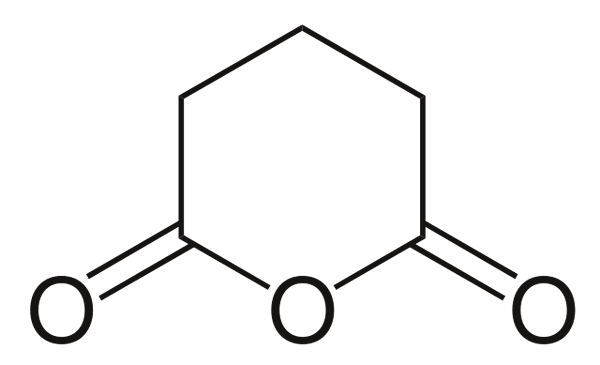 Glutaarinen anhydridi. Lähde: Choij [julkinen verkkotunnus], Wikimedia Commons
Glutaarinen anhydridi. Lähde: Choij [julkinen verkkotunnus], Wikimedia Commons Ja lopuksi glutariinihapon anhydridi on esitetty. Tämä erottaa rakenteellisesti kaikki muut koostumalla kuusikulmainen rengas. Jälleen kolme happiatomia erottuvat rakenteesta.
Kolme happiatomia voi aina osoittaa muut monimutkaisemmat anhydridit hyvin lähellä toisiaan.
Viitteet
- Anhydridi. Enclyclopaedia Britannica. Toipunut: Britannica.com
- Happihappoanhydridin määritelmä kemiassa. Toipunut: Admingco.com

