Tukea ominaisuuksia, toimintoja ja esimerkkejä
- 3876
- 246
- Eddie Hackett
Se tuet Ne ovat entsyymien passiivisia muotoja, ts. Ne ovat entsyymejä, joilla ei ole kofaktoriaan tai koentsyymejä, jotka ovat välttämättömiä katalyyttisten reaktioiden suorittamiseksi, joista he ovat vastuussa.
Entsyymit ovat proteiineja, joilla on katalyyttinen aktiivisuus. Sen toiminta kiihdyttää periaatteessa solujen erityyppisten kemiallisten reaktioiden kulkua, mikä on erittäin tärkeä kaikkien elävien olentojen olemassaololle maan päällä.
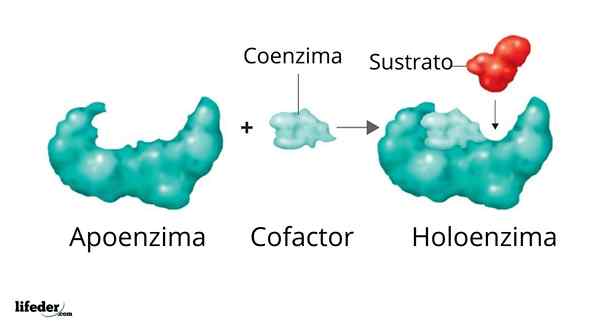
 Kannattaja ja sen kofaktori/koentsyymi/proteesiryhmä muodostaa holoentsyymin
Kannattaja ja sen kofaktori/koentsyymi/proteesiryhmä muodostaa holoentsyymin Monien entsyymien aktiivisuus riippuu niiden muodostavien aminohappojen identiteetistä ja järjestyksestä, toisin sanoen omilla proteiinirakenteillaan ja näiden rakenteiden eheydestä olosuhteissa alkuperäinen.
Vaikka tämä pätee moniin entsyymeihin, jotkut vaativat ylimääräisiä ei -proteiinielementtejä toimintojensa suorittamiseksi. Tällaiset elementit tunnetaan nimellä Kofaktorit, Jos nämä ovat epäorgaanisia ioneja, tai koentsyymit, Jos nämä ovat monimutkaisia tai orgaanisia molekyylejä.
Yleensä sekä kofaktorit että koentsyymit liittyvät suhteelliseen stabiilisuuteen entsyymien proteiinirakenteeseen, jonka katalyyttinen aktiivisuus edistää; Kun tämä assosiaatio on pysyvä (kovalenttinen), nämä ryhmät tunnetaan sitten nimellä Proteesiryhmät.
Esimerkkejä tuesta
 3D -kuva DNA -polymeraasista
3D -kuva DNA -polymeraasista Aktiivinen entsymaattinen sarja, joka muodostuu proteiinista, jolla on katalyyttinen aktiivisuus, ja sen kofaktori/koentsyymi/proteesiryhmä kutsutaan Holoentsyymi jompikumpi konjugoitu entsyymi. Holoentsyymissä proteiiniosa vastaa ns tukeva tai apoproteiini, josta puuttuu aktiivisuus.
Esimerkkejä tärkeistä tuista ovat:
- Entsyymi DNA -polymeraasi, Solu DNA: n replikaatio, ilman kaksiarvoista magnesium -ionia, joka toimii kofaktorina.
- Entsyymi Hiilihydraasi, Vastuussa CO₂: n ja H₂0: n muuntamisen katalysoinnista bikarbonaatiksi ja H+-ioneiksi, ilman kofaktorina toimivaa kalliita sinkki -ionia.
- Entsyymi hemoglobiini, Vastuussa nisäkkäiden eläinten veren kautta punasolujen (punasolujen) hapen kuljettamisesta ilman niiden proteesiryhmää Hemo.
- Entsyymi laktaattidehydrogenaasi, Vastuu laktaatin tuotannosta pyruvaatista, ilman kofaktorina toimivaa NADH: ta.
Apoentsyymien ominaisuudet
Tuki on passiivisia entsyymejä, joita he tarvitsevat aktivoinnin saavuttamiseksi kofaktorin tai koentsyymin liiton, mutta joita ei ole yhtenäisiä yhteen.
Tämän huomioon ottaen voidaan sanoa, että sellaisilla molekyyleillä on tietyt ominaisuudet, nimittäin:
Ne ovat proteiineja
Toisin kuin kofaktorit ja koentsyymit, jotka ovat ei -proteiinielementtejä, joita tarvitaan holoentsyymien toimintoihin, tuki ovat proteiineja.
Aikaisempi lausunto ymmärretään siis, että tuet muodostuvat aminohapoiksi tunnetuista erityismolekyylien ketjuista, jotka on kytketty toisiinsa peptidisidoksen tyypin kautta.
Kunkin tuen aminohapposekvenssi määritetään geneettisesti, ja tämä puolestaan on olosuhteissa sen tila- tai kolmiulotteinen järjestys, joka liittyy läheisesti substraattien spesifisyyteen, liiton kofaktoreille/koentsyymeille/proteesiryhmille, aktiivisen kohdan muodostuminen, aktiivisen kohdan muodostuminen, jne.
Proteiineina apoentsyymeillä on myös: sähkövaraus, joka määritetään niiden aminohappopitoisuuksien ja niiden löydetyn väliaineen pH: n perusteella; Lämpötila-, pH- ja ionivoiman vaatimukset ominaisuudet, joissa se voi kofaktorien läsnä ollessa toimia optimaalisella nopeudellaan; estäjät ja kilpailijat jne.
He voivat liittyä substraateihin
Vaikka he eivät sinänsä pysty katalysoimaan entsymaattista reaktiota, monet tuet säilyttävät kyvyn liittyä heille ominaisen reaktioon osallistuviin substraatteihin; Tästä syystä niitä käytetään yleensä joissakin kokeellisissa yhteyksissä.
He voivat liittyä kofaktoreihin, koentsyymeihin tai proteesiryhmiin
Useimmissa tapauksissa tukia voidaan pitää passiivisina entsyymeinä, jotka ovat valmis Liittyä heidän toimintoihinsa osallistuviin molekyyleihin, toisin sanoen heidän kofaktoreilleen, koentsyymeille tai proteesiryhmille.
Se voi palvella sinua: Ecuadorian rannikon kasvisto ja eläimistöKofaktorit voivat osallistua suoraan katalyyttisiin reaktioihin tai yksinkertaisesti edistää holoentsyymin yleisen rakenteen stabilointia.
Solun holoentsyymeihin osallistuvien tärkeimpien kofaktorien joukossa ovat:
- Rauta (Fe2+)
- Kupari (Cu2+)
- Kalsium (CA2+)
- Sinkki (Zn2+)
- Magnesium (MG2)
- Mangaani (MN2+)
- Koboltti (CO)
- Nikkeli (Ni)
Tärkeimmistä koentsyymeistä voidaan nimittää:
- Vitamiinit: B9, B3, C
- Adenosín triffosfaatti (ATP)
- Flavín Adenín Dinucleotid (FAD)
- Nicotinamidi tai Nicotín Dinucleotide Dycleotide (NAD)
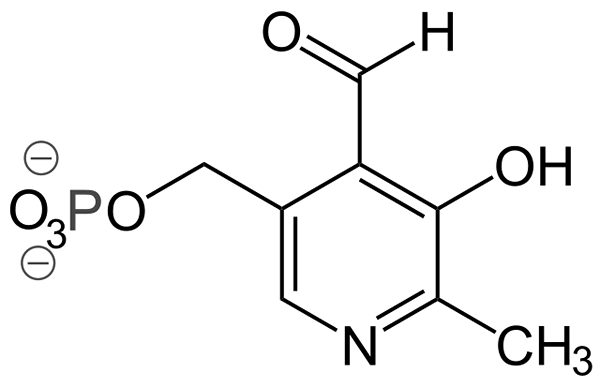 Piridoksaalifosfaattirakenne (lähde: Ayacop, julkinen alue, Wikimedia Commonsin kautta)
Piridoksaalifosfaattirakenne (lähde: Ayacop, julkinen alue, Wikimedia Commonsin kautta) Jotkut tärkeät proteesiryhmät ovat:
- Hemo -ryhmä
- Biotiini
- Tiamiinipyrofosfaatti
- Pyridoksaalifosfaatti
Subenziman toiminnot
Koska tuet ovat holoentsyymien proteiiniosoja, on kohtuullista pitää niitä heidän tärkeimpänä osana. Jopa sopivien koentsyymien, koentsyymien ja substraattien läsnä ollessa, ilman tukia, mitään näiden entsyymien katalysoimista entsymaattisista reaktioista ei voitu suorittaa.
Tässä mielessä tuen päätehtävä on myötävaikuttaa sekä holoentsyymin päärakenteeseen, johon se kuuluu, kofaktorin unionin, koentsyymin ja/tai proteesiryhmän sekä reaktioon osallistuvien substraattien kanssa.
Rakenteellisesta näkökulmasta holoentsyymi ilman sen apoentsyymiä ei ole muuta kuin kofaktori, ja pelkästään kofaktori ei ole muuta kuin suhteellisen inertti molekyyli (biologisesti ottaen), joten tuki on tosiasiassa toteutettavissa Katalyyttinen reaktio, jota avustavat mainitut ei -proteiinielementit.
Voi palvella sinua: ActinomycetesSiten tuen toiminnot, vaikka se on passiivisia entsyymejä, riippuvat:
- Sen lineaarinen aminohappoketju tai primaarirakenne (jos ne ovat entsymaattisia komplekseja, jotka on muodostettu useamman kuin yhden alayksikön, niin siitä keskustellaan niiden lineaarisista ketjuista)).
- Tapa, jolla nämä ketjut on tilattu avaruuteen, toisin sanoen toissijainen, tertiäärinen ja kvaternäärinen rakenne, kun tapaus.
- Katalyysille perusteellisten kohtien oikea konformaatio, toisin sanoen reaktioon osallistuvien aminohappojen katalyyttinen kohta, Co -entsyymien, koentsyymien tai proteesiryhmien unionin kohta; jne.
- Rakenteen stabiilisuus soluolosuhteissa tai alkuperäinen, tosiasia, joka liittyy suoraan apoentsyymin kykyyn muodostaa holoentsyymiä ja muita.
Viitteet
- Boyer, P. D -d., & Krebs, ja. G. (1986). Entsyymit. Akateeminen lehdistö.
- Garrett, r. H., & Grisham, c. M. (2001). Biokemian periaatteet: ihmisen keskittymällä. Brooks/Cole Publishing Company.
- Gruber, k., Puffer, b., & Krautler, b. (2011). B-vitamiini 12-johdannaiset-entsyymi-tekijät ja proteiinien ja nukleiinihappojen ligandit. Chemical Society Reviews, 40 (8), 4346-4363.
- Murray, r. K -k -., Granner, D. K -k -., Mayes, P. -Lla., & Rodwell, V. W -. (2014). Harperin kuvitettu biokemia. McGraw-Hill.
- Nelson, D. Lens., Lehninger, a. Lens., & Cox, M. M. (2008). Lehninger -biokemian periaatteet. Macmillan.
- Staiano, m., Pennacchio, a., Varriale, a., Capo, a., Majoli, a., Capacchione, c., & D'Auria, S. (2017). Entsyymit antureina. Entsymologian menetelmissä (VOL. 589, s. 115-131). Akateeminen lehdistö.
- « Vetoomuksen esittäjä, mikä on käyttö, esimerkki, muoto (malli)
- Haara hengitys miten se tehdään ja esimerkkejä »

