Natrium Azida (NAN3) -rakenne, ominaisuudet, käytöt, riskit

- 833
- 188
- Shawn Stanton II
Se Natriumalokivi Se on natrium -ionin NA: n muodostama kiteinen epäorgaaninen kiinteä aine+ Ja Azida n -ioni3-. Sen kemiallinen kaava on Nan3. NAN -yhdiste3 Se on HN -hydratsoehapon natriumsuola3. Nan3 Se on kiteinen kiinteä väritön tai valkoinen.
Vaikka se on erittäin myrkyllinen yhdiste, yksi sen laajimmista työpaikoista on ollut turvatyynyissä, jotka ovat heti tartunnan saaneet ajoneuvojen onnettomuuksien aikana. Sen tarkoituksena on myös nopeasti paisuttaa lentokoneen hätäliukumäet. Tällä hetkellä sen käyttöä on kuitenkin erittäin kyseenalaistettu molemmissa tapauksissa sen myrkyllisyyden vuoksi.
 Natrium Nan Azid3 kiinteä. И.С. Непоконов [cc by-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
Natrium Nan Azid3 kiinteä. И.С. Непоконов [cc by-Sa 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. Sitä käytetään kemiallisissa tutkimuslaboratorioissa erityyppisten yhdisteiden syntetisoimiseksi ja biokemiallisissa laboratorioissa bakteerien, sienten tai nisäkkäiden tai ihmisen solujen tutkimuksiin.
Joissakin laboratorioissa sitä käytetään materiaalien tai laitteiden sterilointiin, mutta tietyntyyppiset mikro -organismit vastustavat niiden biosidisia vaikutuksia.
Sitä on käytetty myös maataloudessa maaperän loisten tai puuteollisuuden poistamiseksi mäntypuun värjäytymisen estämiseksi sienillä.
[TOC]
Rakenne
Natrium azida nan3 Se muodostuu natrium -kationista+ ja atsidi -anioni n3-.
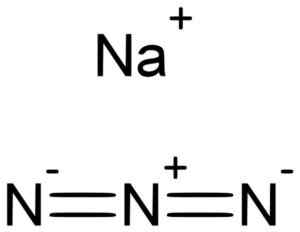 Natrium azida muodostuu natrium -na+ Ja Azida n -ioni3-. Lukáš Mižoch [julkinen alue]. Lähde: Wikimedia Commons.
Natrium azida muodostuu natrium -na+ Ja Azida n -ioni3-. Lukáš Mižoch [julkinen alue]. Lähde: Wikimedia Commons. Azida n -ioni3- Se koostuu kolmesta typpiatomista (N) toistensa yhdistämisestä kovalenttisilla sidoksilla, jotka voivat olla yksinkertaisia, kaksinkertaisia tai kolminkertaisia, koska elektronit jaetaan kolmen kesken.
Tällä anionilla on lineaarinen rakenne, ts. Kolme typpiatomia, jotka on järjestetty suorassa linjassa. Lisäksi rakenne on symmetrinen.
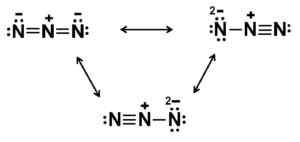 Azida -anionin mahdolliset Lewis -rakenteet. Kirjoittaja: Marilú Stea.
Azida -anionin mahdolliset Lewis -rakenteet. Kirjoittaja: Marilú Stea. Nimikkeistö
- Natriumalokivi
- Natrium Azida
Ominaisuudet
Fyysinen tila
Kiteinen yksiväritön tai valkoinen. Kuusikulmaiset kiteet.
Molekyylipaino
65,01 g/mol
Sulamispiste
Se hajoaa 275 ºC: n nopeudella.
Tiheys
1 846 g/cm3 20 ºC
Liukoisuus
Se on hyvin liukoinen veteen: 41,7 g/100 ml 17 ° C: ssa. Se liukenee hiukan etanoliin ja liukenematon etyylieetteriin.
Dissosiaatiovakiot
Siinä on PKb - 9.3. Vesipitoiset liuokset sisältävät NH: n3, joka poistuu nopeasti ympäristöstä 37 ºC: n nopeudella.
Kemialliset ominaisuudet
Nan3 Se on hyvin syövyttävää alumiinia kohtaan ja kohtalaisesti kohti kuparia ja lyijyä.
Voi palvella sinua: typen valenssitTietyn neuvotetun lähteen mukaan natrium -atsidi ei ole räjähtävä. Se hajoaa varovasti ja kokonaan, kun sitä kuumennetaan vähintään 300 ºC: lla, muodostaen natriummetallia ja typpikaasua n2.
2 Nan3 → 2 Na + 3 N2↑
Se on nitroraatioaine, tämä tarkoittaa, että se on typpeä tai lisää typpeä muihin kemiallisiin yhdisteisiin tai materiaalien pintaan, kuten teräs.
Se on vakaa neutraalissa tai alkalisessa vedessä valon puuttuessa. Se hajoaa aurinkosäteilyn kautta.
Biokemialliset ominaisuudet
Natrium -atsidi estää sytokromioksidaasia, jota löytyy solujen mitokondrioista, ja se on merkittävästi mukana hengityksessä ja energian muodostumisessa tässä.
Sen toiminta estää ATP -muodostumisen avainyhdisteestä soluaktiivisuuksissa ja solu huononee tai vahingoittaa.
Jos se on nautittu, hengitetty tai kosketus natrium -atsidiin, se on erittäin myrkyllinen ja voi tulla tappavaksi.
Saada
NH: n ammoniakki reagoi3 Metallilla Sodio Na: lla 350 ºC: ssa suljetussa teräsastissa, joka saa amidia natrium -nanhista2.
Natrium -nanh2 Se reagoi dyitppi -monoksidin n kanssa2Tai 230 ° C: ssa nikkelireaktorissa, ja siten muodostuu natrium -nanin seos3, Natriumhydroksidi NaOH ja ammoniakki NH3.
2 Nanh2 + N2O → Nan3 + NaOH + NH3
Se voidaan saada myös reagoimalla natriumamidia nano -natriumnitraatin kanssa3 nopeudella 175 ºC:
3 Nanh2 + Vanhempi veli3 → Nan3 + 3 NaOH + NH3
Atsidin puhdistamiseksi vettä lisätään seokseen, atsidin kiteet pestään ja sitten vesi haihtuu. Jäljellä oleva kiteinen materiaali on natrium -nanin atsidi3 joka sitten kuivuu 110 ºC: n nopeudella.
Sovellukset
Moottoriajoneuvoissa ja lentokoneissa
Natrium -atsidia on käytetty laajasti autoteollisuudessa typpigeneraattorina turvatyynyjen nopeasti täyttämiseksi (englanti Turvatyynyt) Auton lentolehtisten ja kuorma -autojen turvallisuus, kun isku tapahtuu.
Sitä on käytetty myös puhallettavissa dioissa, jotka toimivat nopeasti hätätilanteissa laskeutuneiden lentokoneiden sisäpuolelta.
Molemmissa tapauksissa mekanismi sisältää kipinän vaikutuksen välittömän reaktion tuottamiseksi natrium -atsidin ja tiettyjen yhdisteiden välillä, aiheuttaen typpikaasua n2 ja natriumoksidi NA2JOMPIKUMPI.
Voi palvella sinua: kaksinkertainen korvausreaktioTämä sovellus vaatii kylmän ja ei-teknisen kaasun välittömän vapautumisen, joten typpi on sopivin kaasu.
 Turvapussit, joita on jo käytetty ajoneuvoissa. Kirjoittaja: Marcel Langthim. Lähde: Pixabay.
Turvapussit, joita on jo käytetty ajoneuvoissa. Kirjoittaja: Marcel Langthim. Lähde: Pixabay. Tämä käyttö vähenee kuitenkin natrium -atsidin toksisuuden vuoksi, ja sen sijaan niitä käytetään vähemmän myrkyllisiä yhdisteitä.
Kemianteollisuudessa
Sitä käytetään sienien kumivalmistuksen hidastimena, venytyksen tai butadieenilateksin hyytymisen estämiseksi, kun niitä säilytetään kosketuksessa metallien kanssa ja hajottaa nitriittejä nitraattien läsnä ollessa.
Maataloudessa
Sitä on käytetty maataloudessa: biosidisena ja fumigantina, se on myös nemaattidia, ts. Sitä käytetään maaperässä nematodien poistamiseksi, jotka ovat loisia, jotka hyökkäävät joihinkin viljelyihin.
 Nematodien aiheuttamat vauriot kasvin juuressa. Kirjoittaja: Redwolf. [http: // www.Ars-grin.Gov/ARS/SOATLANT/FP/STPP/BURELLE/BURELLE.HTML] Lähde: Wikimedia Commons.
Nematodien aiheuttamat vauriot kasvin juuressa. Kirjoittaja: Redwolf. [http: // www.Ars-grin.Gov/ARS/SOATLANT/FP/STPP/BURELLE/BURELLE.HTML] Lähde: Wikimedia Commons. Se on myös toiminut rikkakasvien torjunta -aineena ja välttää mädäntyviä hedelmiä.
Äskettäin Nan3 Sitä on käytetty Okra- tai Quimbombó -siementen valmistuksessa tarkkailemaan sen resistenssejä vedenvestoolosuhteisiin.
Siemenet, joihin Nan oli aiemmin levitetty3 He tuottivat taimia, jotka vetivät tulva -olosuhteet paremmin kuin kohtuuttomat, paransivat kasvien korkeutta, lisäsivät lehtien lukumäärää ja kasvattivat juurten määrää jopa ylimääräisen veden kanssa.
Muiden kemiallisten yhdisteiden valmistuksessa
Sitä käytetään kemiallisena reagenssina orgaanisten yhdisteiden synteesissä, esimerkiksi monien orgaanisten atsidien, kuten tertiäärisen alkyyliryhmän atsidien, valmistamiseksi, jotka ovat tärkeitä kemiallisessa synteesissä.
Sen tarkoituksena on valmistella hydratsoiinihappoa (HN3) ja puhdasta natriumia (NA).
Räjähteellä
Natrium azida nan3 Se on välittäjä räjähtävässä valmistuksessa, koska sitä käytetään lyijyatsidin valmistukseen3-A2. Jälkimmäinen on yhdiste, joka räjähtää, kun sitä lyödään voimakkaasti, joten sitä käytetään räjäyttävien laitteiden rakentamisessa.
 Natrium azida nan3 Sitä käytetään PB -lyijyn valmistukseen (n3-A2 yhdiste, joka on osa laitteita räjähdysten tuottamiseksi. Kirjoittaja: OpenClipart-Vektorit. Lähde: Pixabay.
Natrium azida nan3 Sitä käytetään PB -lyijyn valmistukseen (n3-A2 yhdiste, joka on osa laitteita räjähdysten tuottamiseksi. Kirjoittaja: OpenClipart-Vektorit. Lähde: Pixabay. Biokemiallisissa laboratorioissa
Natrium -atsidia käytetään, kun steriilejä laboratoriolaitteita vaaditaan, koska se pystyy tuhoamaan erityyppiset mikro -organismit.
Se voi palvella sinua: Aivolisäkkeen happo (H3PO2): Ominaisuudet, käytöt ja reagenssitSe on biosidinen aine. Jotkut lähteet osoittavat kuitenkin, että jotkut bakteerit ovat resistenttejä niiden vaikutukselle.
Tämä saavutetaan estämällä happea sitoutumiskohta oksidaasisytokromissa, joka on joidenkin mikro -organismien energiantuotantoprosessiin liittyvä entsyymi.
Sitä käytetään automaattisissa verilaskureissa, myös bakteerien differentiaalisessa valinnassa ja laboratorioreagenssiliuosten säilyttämisessä, koska se estää tiettyjen mikro -organismien kasvun näissä.
Useissa käyttötarkoituksissa
Natrium Azida tarjoilee puuteollisuudessa välttääkseen ruskeat sienpaikat mäntypuussa.
Sitä on käytetty myös Japanin olutteollisuudessa välttämään sienen kehitystä, joka tummenee,.
Riskejä
Natrium -atsidi on myrkyllinen yhdiste, joka estää tärkeän entsyymin ihmisen ja eläinten solujen hengitykselle ja elämälle. On havaittu, että se voi vaikuttaa vakavasti aivojen verisuonen solukuolasoluihin.
Sen välitön vaikutus nielemisen, hengityksen tai ihon kosketuksen jälkeen on alentaa verenpainetta vaarallisesti, mikä voi johtaa kuolemaan. Siksi sitä on manipuloitava erittäin varovaisesti.
On tiedonlähteitä, jotka herättävät huomiota ajoneuvojen turvatyynyihin, jotka tuhoutuvat jätealueilla.
Tällaisissa tapauksissa ihmiset, jotka eivät tiedä vaaraa, voivat käyttää NAN -talletuksia3, Tämä on erittäin myrkyllinen yhdiste. Lisäksi Nanin kanssa on vaaraa3 maaperä ja vesi.
Samoin onnettomuuksien, törmäyksen tai ajoneuvopalojen aikana ihmiset voivat altistua Nanille3 Ja hätätilanteeseen osallistuva lääketieteellinen henkilökunta voi aliarvioida tai tuntemattomia.
Huomio sitä käyttämään laboratoriohenkilöstöä varten on kutsuttu myös.
Viitteet
- Vwioko, e.D -d. et al. (2019). Natrium -atsidin pohjustus parantaa vesijohto stressin sietokykyä okrassa (Abelmoschus esculentus-A. Agronomia 2019, 9, 670. MDPI toipui.com.
- Kho, D.T. et al. (2017). Veren aivoesteen kuolema endoteelisolut natrium -atsidiksi ja sen kaasumaisille tuotteille. Biosensorit 2017, 7, 41. MDPI toipui.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Natriumalokivi. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus.
- Talavera, m. et al. (2019). Nematodin hallinta Etelä -Espanjan mansikkakentällä. Agronomia 2019, 9, 252. MDPI toipui.com.
- Okano, t. et al. (tuhatyhdeksänsataayhdeksänkymmentäviisi). Solujen irrottamisen mekanismi lämpötilamoduloiduista, hydrofiilisistä hydrofobisista polymeeripinnoista. Biomateriaalissa: Silver Jubilee -kokoelma. ScienEdirect.com.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Volume A22. Vch verlagsgellschaft mbh.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Chang, S. ja lamm, s.H. (2003). Natriumaltistuksen ihmisten terveysvaikutukset: kirjallisuuskatsaus ja analyysi. Int J Toxicol 2003, 22 (3): 175-86. NCBI toipunut.Nlm.NIH.Hallitus.
- « Hyvää syntymäpäivää parhaat lauseet omistautumiselle
- 105 lauseita uskottomille miehille ja naisille »

