Rikkihistoria, ominaisuudet, rakenne, hankkiminen, käyttö

- 4270
- 1333
- Alonzo Kirlin
Hän rikki Se on ei -metallinen elementti, joka johtaa hapen alapuolelle, laskurin ryhmää jaksollisessa taulukossa. Se sijaitsee erityisesti ryhmässä 16 ajanjaksolla 3, ja sitä esitetään kemiallisella symbolilla S. Sen luonnollisista isotoopeista 32S on nukkumassa paljon (noin 94% kaikista rikkiatomeista).
Se on yksi maan runsaimmista elementeistä, ja se on noin 3% sen kokonaismassaan. Toisin sanoen, jos kaikki planeetan rikki otetaan, kaksi keltaista kuukautta voitaisiin rakentaa; Yhden sijasta olisi kolme satelliittia. Se voi omaksua useita hapettumistiloja (+2, -2, +4 ja +6), joten niiden suoloja on lukuisia ja rikastuttaa maanpäällinen aivokuori ja ydin.
 Rikkikiteet. Lähde: Pixabay.
Rikkikiteet. Lähde: Pixabay. Rikki on synonyymi keltaisille, huonoille hajuille ja helvettiin. Pääasiallinen syy huonoihin hajuihinsa johtuu sen johdetuista yhdisteistä; erityisesti kaasumainen ja orgaaninen. Muista niiden mineraalit ovat kiinteitä ja niissä on värejä, joihin sisältyy keltainen, harmaa, mustavalkoinen (muun muassa).
Se on yksi niistä elementeistä, jotka useimmiten esittelee laajan määrän alotropeja. Sitä voidaan löytää pieninä ja hienovaraisina S: n molekyyleinä2 tai s3; Renkaina tai sykleinä, koska ne ovat ortorromisia ja monokliinisiä rikkiä8 kaikkein vakain ja runsas; Ja kierteisinä ketjuina.
Sen lisäksi, että se löytyy maakuoresta mineraalien muodossa, myös kehomme biologisissa matriiskissa. Esimerkiksi se on kystiini-, kysteiini- ja metioniiniaminohapoissa, rauta-, keratiini- ja vitamiiniproteiineissa. Sitä esiintyy myös valkosipulissa, greippeissä, sipulissa, kaalissa, parsakaalissa ja cauliflorissa.
Kemiallisesti se on pehmeä elementti, ja hapen puuttuessa muodostaa rikki -mineraaleja ja sulfaatteja. Palovammat sinertävällä liekillä ja voidaan näyttää amorfisena tai kiteisenä kiinteänä aineena.
Huolimatta siitä, että se on välttämätöntä rikkihapon, erittäin syövyttävien aineiden ja epämiellyttävien hajujen myöntämisen synteesille, se on oikeastaan hyvänlaatuinen elementti. Rikki voidaan varastoida mihin tahansa tilaan ilman suuria varotoimenpiteitä, kunhan tulipalot vältetään.
[TOC]
Rikin historia
Raamatussa
Rikki on yksi ihmiskunnan historian vanhimmista elementeistä; Niin paljon, että hänen löytönsä on epävarma eikä ole tiedossa, mitä muinaisista sivilisaatioista käytti sitä ensimmäistä kertaa (4000 vuotta ennen Kristusta). Raamatun samoilla sivuilla löydät sen sisäisen tulipalon ja rikkoutumisen mukana.
Uskotaan, että väitetty helvetin haju liittyy vulkaanisiin purkauksiin. Hänen ensimmäisen löytäjänsä piti varmasti ajaa tämän elementin kaivoksiin pölymaita tai keltaisia kiteitä tulivuoren läheisyydessä.
Antiikki
Tämä kellertävä aine osoitti pian merkittäviä parantavia vaikutuksia. Esimerkiksi egyptiläiset käyttivät rikkiä silmäluomien tulehduksien hoitamiseen. Se helpotti myös syyhy ja akne, sovellus, joka nykyään voidaan nähdä rikkihaippuissa ja muissa dermatologisissa esineissä.
Roomalaiset käyttivät tätä elementtiä rituaaleissaan, kuten fumigante ja valkaisu. Kun Librara SOS2, Kaasu, joka tulvii huoneet sekoittaen kosteuden kanssa ja tarjosi antibakteerisen väliaineen ja kykenee tuhoamaan hyönteisiä.
Roomalaiset, kuten kreikkalaiset, löysivät rikin korkean palavuuden, joten siitä tuli synonyymi tulipalolle. Hänen sinertävän liekinsä väri oli valaistettava Rooman sirkut. Sillä välin uskotaan, että kreikkalaiset käyttivät tätä elementtiä sytyttävien aseiden luomiseen.
Heidän puolellaan olevat kiinalaiset saivat tietää, että rikin sekoittaminen Saltpeterin kanssa (Kno3) ja hiili loivat mustan rutkuksen, joka maksoi historiallisen liikevaihdon ja joka herätti tuolloin suuria vaatimuksia ja kiinnostusta tähän mineraaliin.
Se voi palvella sinua: Circononium: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetNykyaika
Ikään kuin ruuti ei olisi riittävä syy rikkiä, rikkihappo- ja teollisuussovelluksia pian syntyivät. Ja rikkihappoa koskevan sauvan kanssa maan varallisuuden tai vaurauden määrä suhteessa sen yhdisteen kulutustasoihin mitattiin.
Vasta vuonna 1789, kun loistava kemisti Antoine Lavoisier pystyi tunnistamaan rikin ja luokittelemaan sen elementiksi. Sitten vuonna 1823 saksalainen kemisti Eilhard Mitscherlich huomasi, että rikki voi pääosin kiteyttää kahdella tavalla: rhomboédrica ja monokliininen.
Rikin historia seurasi samaa yhdisteiden ja sovellusten kanavaa. Rikkihapon valtavan teollisen merkityksen myötä hän seurasi kumiin, penisilliinin synteesiä, kaivostoiminnan hyödyntämistä, rikki -rikkaiden öljy raa'ien, maaperän ravitsemusta jne.
Ominaisuudet
Fyysinen ulkonäkö
Tuulen kiinteä pölyä tai kiteitä. Sen väri on läpinäkymätön sitruuna keltainen, se on mauton ja puuttuu haju.
Nestemäinen ulkonäkö
Nestemäinen rikki on yksittäinen, koska sen alkuperäinen keltainen väri muuttuu punertavan ja tehostuu ja tummenee, jos se läpäisee korkeat lämpötilat. Kun se palaa, sano sininen ja kirkas liekki.
Moolimassa
32 g/mol.
Sulamispiste
115,21ºC.
Kiehumispiste
445ºC.
sytytyspiste
160ºC.
Itsekiinnityslämpötila
232ºC.
Tiheys
2,1 g/ml. Muut alotrooppit voivat kuitenkin olla vähemmän tiheitä.
Molaarinen lämpökapasiteetti
22,75 j/mol · k
Radiokovalenttinen
105 ± 15 pm.
Elektronegatiivisuus
2.58 Pauling -asteikolla.
Vastakkaisuus
S-S-linkit ovat apolaarisia, koska molemmilla rikkiatomilla on sama elektronegatiivisuus. Tämä tekee kaikki sen alotroopit, sykliset tai ketjujen muodossa, apolaariset; Ja siksi sen vuorovaikutukset veden kanssa ovat tehottomia, eikä sitä voida liuottaa siihen.
Rikki voidaan kuitenkin liuottaa apolaarisiin liuottimiin, kuten hiilidisulfidiin, CS2, ja aromaattinen (bentseeni, tolueeni, ksyleeni jne.-A.
Ionit
Rikki voi muodostaa useita ioneja, yleensä anionit. Tunnetuin kaikista on sulfidi, s2-. S2- Sille on ominaista olla iso ja pehmeä Lewisin pohja.
Pehmeä pohjaksi teoria osoittaa, että sillä on taipumus muodostaa yhdisteitä pehmeiden happojen kanssa; Kuten siirtymämetallikationit, mukaan lukien usko2+, Pb2+ ja cu2+.
Elektroninen rakenne ja kokoonpano
Rikki kruunu
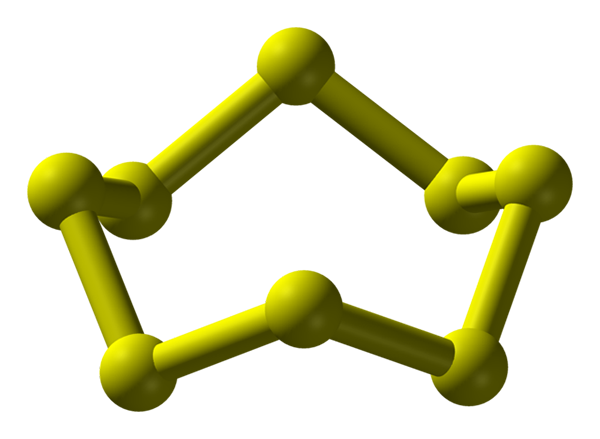 S8 -molekyyli, stabiilin ja runsas rikin alotrooppinen. Lähde: Benjah-BMM27.
S8 -molekyyli, stabiilin ja runsas rikin alotrooppinen. Lähde: Benjah-BMM27. Rikkiä voi esiintyä monenlaisissa alotrooppeissa; ja näissä puolestaan on kiteisiä rakenteita, joita muokataan eri paineissa ja/tai lämpötiloissa. Siksi rikki on rikas elementti alotropoissa ja polymorfeissa, ja sen kiinteiden rakenteiden tutkimus edustaa loputonta teoreettisen ja kokeellisten teosten lähdettä.
Miksi tällainen rakenteellinen monimutkaisuus? Aluksi rikin kovalenttiset sidokset (S-S) ovat erittäin vahvoja, ja ne voittavat vain hiili, c-c ja vety, H-H.
Rikki, toisin kuin hiili, ei yleensä muodosta tetraedraa, vaan bumerangeja; että kulmassa ne taittuvat ja renkaat rikiketjujen vakauttamiseksi. Kaikin tunnetuin rengas, joka edustaa myös rikin vakainta alotrooppista, on S8, "Rikki kruunu" (korkeampi kuva).
Huomaa, että kaikki S-S-linkit8 Ne näyttävät yksittäisiltä bumerangeilta, mikä johtaa renkaaseen, jossa on taito ja tasainen ollenkaan. Nämä kruunut S8 He ovat vuorovaikutuksessa Lontoon joukkojen kautta, jotka ovat suuntautuneita siten, että he onnistuvat luomaan ortorromisen kristallin määrittelevät rakenteelliset kuviot; nimeltään s8 α (S-a tai yksinkertaisesti ortorrominen rikki).
Voi palvella sinua: elastiset materiaalitPolymorfit
Rikki kruunu on yksi monista tämän elementin alotrooppeista. S8 α on tämän kruunun polymorfi. On kaksi muuta (tärkeimpiä) nimeltään s8 β ja s8 γ (s-β ja s-y, vastaavasti s-y). Molemmat polymorfit kiteytyvät monokliinisissä rakenteissa, koska ne ovat8 γ on tiheämpi (rikkigamma).
Kolme ovat keltaisia kiintoainetta. Mutta kuinka kukin polymorfia saadaan erikseen?
S8 β valmistaa S: n8 α 93 ° C: ssa, jolloin sen hidas jäähdytys voi hidastaa sen paluusiirtymistä ortorromiseen vaiheeseen (α). Ja s8 γ puolestaan saadaan, kun se perustuu8 α 150 ° C: ssa, jolloin taas jäähtyy hitaasti; Se on rikki kruunun polymorfien tihein.
Muut sykliset alotroopit
Kruunun s8 Se ei ole ainoa syklinen alotrooppi. On muitakin, kuten S4, S5 (Analoginen syklopentano), S6 (edustaa kuusikulmiota ja sykliä), S7, S9, ja s10-20; Jälkimmäinen tarkoittaa, että voi olla renkaita tai syklejä, jotka sisältävät kymmenestä kahteenkymmeneen rikiatomiin.
Jokainen niistä edustaa erilaisia rikkisyklisiä alotrokeja; Ja puolestaan korostaa sitä, että heillä on lajikkeita polymorfeja tai polymorfisia rakenteita, jotka riippuvat paineesta ja lämpötilasta.
Esimerkiksi s7 Siinä on jopa neljä tunnettua polymorfia: α, β, y ja δ. Korkeamman molekyylimassan jäsenet tai kruunut ovat orgaanisia synteesituotteita, eivätkä ole luonteeltaan vallitsevia.
Rikkiketjut
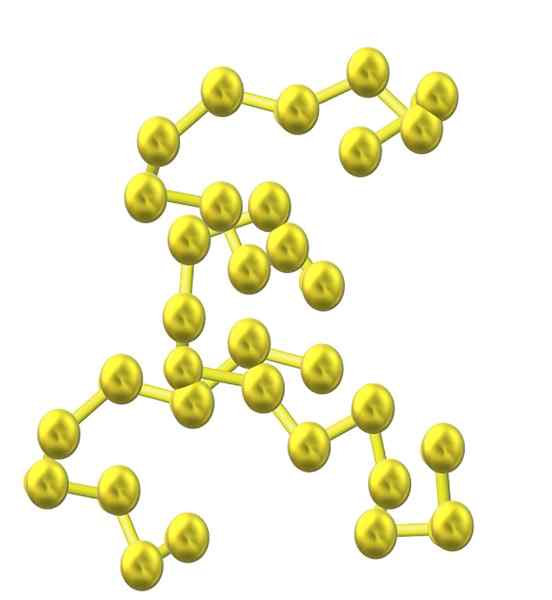 Rikkiketju. Lähde: Opentax [CC BY 4.0 (https: // creativecommons.Org/lisenssit/by/4.0)]
Rikkiketju. Lähde: Opentax [CC BY 4.0 (https: // creativecommons.Org/lisenssit/by/4.0)] Kun rakenteeseen sisällytetään enemmän rikkiatomeja, niiden taipumus rengas vähenee ja rikkiketjut pysyvät avoimina ja omaksuvat kierteiset konformaatiot (ikään kuin ne olisivat spiraaleja tai ruuveja).
Ja siten syntyy toinen rikki -alotropien perhe, joka ei koostu renkaista tai sykleistä, vaan ketjuista (kuten ylemmästä kuvasta).
Kun nämä S-S-ketjut kohdistuvat lasin rinnakkain, ne saavat epäpuhtauksia ja lopulta määrittelevät kuitumaisen kiinteän aineen, jota kutsu. Jos näiden rinnakkaisten ketjujen joukossa on kovalenttisia sidoksia, jotka yhdistävät ne (kuten kumin vulkanoinnin kanssa), meillä on laminaarinen rikki.
Kun rikki s8 Se sulaa kellertävän nestemäisen faasin, joka voi pimeää, jos lämpötila nousee. Tämä johtuu siitä, että S-S-linkit ovat rikki, ja siksi tapahtuu lämpö depolymerointiprosessi.
Tämä neste jäähdytys näyttää muoviominaisuudet ja sitten lasit; eli saadaan lasimainen rikki ja amorfinen (S-olleet). Sen koostumus koostuu sekä renkaista että rikkiketjuista.
Ja kun kuitumaisen ja laminaarisen alotroopin seos saadaan amorfisesta rikkiä, kaupallista tuotetta, jota käytetään kumin vulkanoitumiseen.
Pienet alotroopit
Vaikka ne jätetään viimeksi, ne eivät ole yhtä tärkeitä (tai mielenkiintoisia) kuin suurimpien molekyylimassan alotropos. S2 ja s3 Ovatko O: n rikkiversiot2 Minä3. Kahdessa ensimmäisessä rikiatomissa ne liittyvät kaksoissidoksella, s = s, ja toisessa on kolme atomia, joissa on resonanssirakenteita, s = s-s.
Molemmat s2 kuten S3 Ne ovat kaasumaisia. S3 Ilmenee kirsikanpunainen väri. Molemmilla on tarpeeksi bibliografista materiaalia jokaiselle yksittäisen artikkelin peittämiseksi.
Elektroninen kokoonpano
Rikkiatomin elektroninen kokoonpano on:
[Ne] 3s2 3P4
Voit ansaita kaksi elektronia Valencian Octeton loppuun saattamiseksi, ja siten hapettumistila on -2. Samoin voit menettää elektroneja, alkaen kahdesta sen 3p -kiertoradalla, koska se on sen hapettumistila +2; Jos menetät vielä kaksi elektronia tyhjillä 3p -kiertoradalla, hapetustilasi on +4; Ja jos menetät kaikki elektronit, se on +6.
Voi palvella sinua: metalloiditRikin saaminen?
Mineraloginen
Rikki on osa monia mineraaleja. Niiden joukossa on pyriitti (FES2), La Galena (PBS), Covellita (CUS) ja muut sulfaatti- ja sulfidi -mineraalit. Käsittelemällä niitä, metallit voidaan erottaa, vaan myös rikki pelkistävien reaktioiden sarjan jälkeen.
Se voidaan saada myös puhtaasti vulkaanisissa tuuletusaukkoissa, missä lämpötila nostetaan ja vuotaa alamäkeen; Ja jos hän sytyttää, hän näyttää sinertävältä laavalta. Vaarallisen työn ja rasittavien fysikaalisten töiden kautta rikki voidaan kerätä, koska se tehtiin melko usein Sisiliassa.
Rikkiä löytyy myös maanalaisista kaivoksista, jotka on valmistettu ylikuumenemisen veden pumppaamiseksi sulamaan ja siirtämään se pintaan. Tämä hankkimisprosessi tunnetaan nimellä Brasch -prosessi, tällä hetkellä vähän käytettyjä.
Maaöljy
Nykyään suurin osa rikkiä on peräisin öljyteollisuudesta, koska sen orgaaniset yhdisteet ovat osa öljyn raakaöljyn ja sen hienostuneiden johdannaisten koostumusta.
Jos hienostunut raaka tai tuote on runsaasti rikkiä ja tapahtuu hydrodesulfurisaatiota, se vapauttaa suuria määriä H2S (haiseva kaasu, joka haisee mätät munat):
R-S-R + 2 H2 → 2 Rh + H2S
Sitten h2S Se on kemiallisesti Clauss -prosessissa, tiivistetty seuraavilla kemiallisilla yhtälöillä:
3 o2 + 2 h2S → 2 niin2 + 2 h2JOMPIKUMPI
Sw2 + 2 h2S → 3 s + 2 h2JOMPIKUMPI
Sovellukset
Osa rikkitarkoituksista mainitaan alla ja yleensä:
- Se on olennainen osa sekä kasveille että eläimille. Sitä on jopa kahdessa aminohapossa: kysteiini ja menetelmä.
- Se on rikkihapon raaka -aine, joka koostuu lukemattomien kaupallisten tuotteiden valmistuksessa.
- Lääketeollisuudessa se on tarkoitettu rikkijohdannaisten synteesille, penisilliini on tunnetuin esimerkeistä.
- Mahdollistaa kumien vulkanoinnin yhdistämällä polymeeriketjut S-S-linkillä.
- Sen keltainen väri ja seokset muiden metallien kanssa tekevät siitä toivottavaa pigmenttiteollisuudessa.
- Sekoitettu epäorgaanisen matriisin, kuten hiekan ja kivien, betonin ja rikin asfaltin kanssa, valmistetaan bitumin korvaamiseksi.
Riskit ja varotoimet
Rikki yksinään on vaaraton, ei -toksinen aine ja edustaa myös potentiaalisia riskejä, ellei reagoida muihin yhdisteisiin. Sen sulfaattisuolat eivät ole vaarallisia ja niitä voidaan manipuloida ilman suuria varotoimenpiteitä. Tätä ei kuitenkaan tapahdu sen kaasumaisilla johdannaisilla: niin2 ja h2S, molemmat erittäin myrkylliset.
Jos se on nestemäisessä vaiheessa, se voi aiheuttaa vakavia palovammoja. Jos se on suuria määriä, H voi laukaista2S suolistossa. Muita se ei edusta riskiä niille, jotka pureskelevat.
Yleisesti ottaen rikki on varma elementti, joka ei vaadi liian monia varotoimenpiteitä, paitsi pitämällä se poissa tulesta ja vahvoista hapettumisaineista.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Laura crapanzano. (2006). Rikin polymorfismi: rakenteelliset ja dynaamiset näkökohdat. Fysiikka [fysiikka].Yliopisto Joseph -Fourier - Grenoble I. Englanti. Fftel-00204149f
- Wikipedia. (2019). Rikin allotroopit. Haettu: vuonna.Wikipedia.org
- Meyer lyö. (1976). Perusrikki. Chemical Reviews, Vol. 76, ei. 3.
- DR. Doug Stewart. (2019). Rikkielementit. Kemikooli. Toipunut: Chemicool.com
- Donald W. Davis ja Randall a. Detrot. (2015). Rikehistoria. Georgian Gulf Sulphur Corporation. Toipunut: Georgiagulfsulfur.com
- Helmestine, Anne Marie, PH.D -d. (11. tammikuuta 2019). 10 mielenkiintoista rikkitietoa. Toipunut: Admingco.com
- Boone, c.; Sidos, c.; Hallman, a.; Jenkins, J. (2017). Yleinen rikkitietolomake; Kansallinen torjunta -ainetietokeskus, Oregonin osavaltion yliopiston laajennuspalvelut. NPIC.Orst.Edu
- « Itsenäisyys Meksikosta syyt, kehitys, seuraukset, hahmot
- Jaliscon edustavien lajien kasvisto ja eläimistö »

