Bromotimolin sininen

- 4489
- 1082
- Shawn Stanton II
 Bromotimoli sininen on pH -indikaattori. Lähde: Wikimedia Commons
Bromotimoli sininen on pH -indikaattori. Lähde: Wikimedia Commons Mikä on bromotimolin sininen?
Hän Bromotimolin sininen Se on trifenyylimetanon johdannainen, joka toimii pH -indikaattorina. Indikaattori on orgaaninen väriaine, jonka väri riippuu ionin H: n pitoisuudesta3JOMPIKUMPI+ tai keskipitkästä pH: sta. Sen värin takia indikaattori voi viitata liuoksen happamuuden tai alkalisuuden.
Bromotimolin sinisellä on aktiivinen indikaatioasteikko pH 6: n välillä.0 ja 7.6. Alle 6 väliaineen pH: lle.5 (happo) ilmenee keltainen väri. Kun väliaine pH vaihtelee välillä 6.5 ja 7.6 (neutraali), saa vihreän värin. PH yli 7.6 sen väri on sininen (perus).
Tämä ominaisuus antaa sille loistavan hyödyllisyyden, koska sitä voidaan käyttää pH -asteikolla lähellä puolueettomuutta, tarkalleen missä fysiologisia prosesseja tapahtuu.
Bromotimolin sininen ionisaatio vesiliuoksessa voidaan kaavioida seuraavasti:
Hin (keltainen) +h₂o sisään- (sininen väri) + h3JOMPIKUMPI+
Kun indikaattori protonoidaan (HIN) saa keltaisen värin; Kun taas indikaattori on suojaamaton (-) Väritys on sinistä.
Kemiallinen rakenne
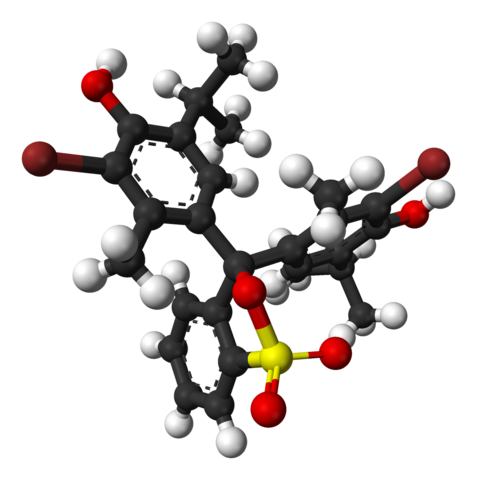 Bromotimolin sinisen kemiallinen rakenne. Lähde: Wikimedia Commons
Bromotimolin sinisen kemiallinen rakenne. Lähde: Wikimedia Commons Yläkuvassa bromotimolin sinisen rakenne on esitetty palkkimallilla ja pallot alle 7: n pH: lle.1. Ruskeat palkit vastaavat bromiatomeja, yhteensä kaksi.
Jokainen kolmesta aromaattisesta renkaasta koostuu metyyliryhmien vieressä CH3, Ja terminen, timoliryhmä ja linkitettynä BR, sieltä syytä kutsutaan 'bromotimoliksi'.
Voi palvella sinua: hydroksiditAlaosassa sulfonaattiryhmä on esitetty, r-niin3-, Punaisella alueella ja keltaisella. Tämä ryhmä voidaan yhdistää atomin tai keskushiilen kautta, joka liittyy kolmeen aromaattiseen renkaaseen.
PH -muutokset
Tämä molekyylirakenne, vaikka se ei muutu radikaalisti happamalla tai emäksisellä pH: lla, muuttaa sen elektronisia tiloja, jotka heijastuvat liuosten värimuutoksilla.
PH 7: n alapuolella indikaattori on keltainen ja hyväksyy kuvan rakenteen, mutta jos pH: sta tulee emäksistä, ryhmät -OH ovat valitettavia ja kaksoissidos voidaan muodostaa C = O.
Seurauksena on, että molekyylin konjugoitu järjestelmä (kaikkien sen kaksoisresonanssisidoksista) muuttuu tarpeeksi niin, että elektronit eivät enää absorboi samoja fotoneja, ja liuos muuttuu keltaisesta sinertäväksi.
Jos toisaalta pH on selvästi alle 7, indikaattorin väri muuttuu keltaisesta punaiseksi. Tässä konjugoidun järjestelmän muutos johtuu ryhmien protonoinnista -OH a -OH2+. -
Sekä happamassa että emäksisessä väliaineessa molekyyli menettää stabiilisuuden, absorboimalla pienempiä fotoneja, jotta katsojien havaitsemista väreistä vastaa elektronisia siirtymiä.
Pääkuvassa havaittu vihreä väri johtuu seuraavasta: kun pH 7: n likimääräisissä.1, pieni osa molekyyleistä menettää protoneja, sanoen hyvästit sinisellä värillä, joka sekoittuu keltaiseen, antaa vihreän värin.
Ominaisuudet dBromootimolin sininen
Kemiallinen nimi
Bromotimoli sininen tai 3,3'-dibromoTimolsulfonafet.
Molekyylikaava
C27H28Br2JOMPIKUMPI5S.
Molekyylipaino
624.384 g/mol.
Fyysinen ulkonäkö
Yksivärinen pöly, joka vaihtelee vaaleanpunaisen ja violetin välillä.
Voi palvella sinua: butanal: rakenne, ominaisuudet, käytöt ja riskitKemiallinen ominaisuus
Toimii heikkona happona liuoksessa. Kun se protonoidaan happamassa väliaineessa, se saa keltaisen värin, neutraali pH on vihreä ja kun se on epämiellyttävä alkalisessa pH: ssa, se on sininen.
Ioninen dissosiaatiovakio (KA)
7.9 x 10-8.
Aktiivinen indikaatioalue
pH 6.0 - 7.6. Tämä johtuu bromiatomien läsnäolosta, jotka vaikuttavat elektroneihin, ja kaksi kohtalaista elektroniryhmää (alkyylisubstituentit).
Tiheys
1.25 g/cm3.
Sulamispiste
202 ° C (396 ° F).
Kiehumispiste
184.9 ° C.
Liukoisuus
Se on tuskin liukoinen veteen ja öljyyn. Se on myös vähän liukoinen ei -polaarisiin liuottimiin, kuten bentseeniin, tolueeniin ja ksyleeniin, ja käytännössä liukenematon öljyeetteriin. Se liukenee alkalin ja alkoholin vesiliuoksiin.
Vakaus
Se on vakaa ympäristön lämpötilassa ja yhteensopimaton vahvojen hapettavien aineiden kanssa.
Valon imeytyminen
Protonoidun muodon suurin absorptio on 427 nm: n aallonpituudella (λ), mikä välittää keltaista valoa happoliuoksissa, ja suojaamattomalla muodossa on maksimaalinen absorptio aallonpituudella (λ) 602 nm, välittäen valon vaalean sininen - emäksinen pH.
Käyttö ja sovellukset
Aineenvaihduntatutkimuksissa
Bromotimolin sinistä käytetään lukuisissa prosesseissa, joissa tuotetaan hiilidioksidia (CO₂), minkä seurauksena hiilihapon muodostuminen (H2Yhteistyö3;.
Jos henkilö suorittaa fyysistä harjoitusta ja on kytketty putkeen, joka puolestaan on yhteydessä säiliön kanssa, jolla on bromotimolin sininen liuos, havaitaan seuraavaa ilmiötä: fyysisen aktiivisuuden lisääntymisen seurauksena ja seurauksena Aineenvaihdunta, CO₂ -tuotannon lisääntyminen tapahtuu.
Voi palvella sinua: pii: historia, ominaisuudet, rakenne, hankkiminen, käyttöCO₂ reagoi veden kanssa tuottaen hiilihappoa, H2Yhteistyö3, joka myöhemmin dissosioituu ionin H vapauttaen+ ja väliaineen happamista. Tämä johtaa siihen, että bromotimoli sininen saa keltaisen värin, korostaen ympäristön happamuutta.
Synnytyksessä
Bromotimolin sinistä käytetään synnytyslääketieteellisissä kalvojen varhaisen repeämän osoittamiseksi. Amnioottisella nesteellä on yleensä pH yli 7.7, niin bromotimolin sininen värjää siniseksi, kun se on yhteydessä Amnio -paeta nesteeseen.
Emättimen pH on yleensä hapan, joten bromotimoli sinisellä on keltainen väri. Värin muutos siniseksi ilmenee amnioottisen nesteen esiintymisen emättimen alueella.
Muut käyttötarkoitukset
Bromotimoli sinisellä on myös levitys seuraavissa laitteissa ja toiminnoissa:
- Optiset anturit
- Kaasun palamisen havaitsemisjärjestelmät
- Maalausten, lelujen, puhdistustuotteiden, pesuainten ja tekstiilien laatimisessa
- Ruoan tuoreusanturit
- Tuoreina riistunnisteina ja räätälöinä
- Mikro -organismien havaitsemisessa.
Sitä käytetään myös bakteerien kasvuanalyysissä, psykoaktiivisissa lääkkeissä ja hammasmateriaaleissa.
Valmistautuminen
100 mg bromotimolin sinistä liuotetaan 100 ml: aan laimennettua alkoholia ja suodattimia tarvittaessa. Se valmistetaan myös seuraavasti: 50 mg bromotimolin sinistä liuotetaan 4 ml: n 0,02 N natriumhydroksidia ja 20 ml alkoholia, joka on valmistettu 100 ml vedellä vedellä vedellä vedellä.
Viitteet
- Foist l. Bromothymol Blue: Määritelmä, käyttö ja kaava. Tutkimus toipunut.com
- Bromothymol -sininen pH -indikaattori, 1 unssi. ScienceCompany.com
- Bromothymol -sinisen indikaattorin PK: n spektrofotometrinen määritys. Palautettu FCH: sta.Tupla.cz

