Kemiallisten yhtälöiden tasapainotus
- 803
- 2
- Alonzo Kirlin
Mikä on kemiallisten yhtälöiden tasapainotus?
Kemiallisten yhtälöiden tasapainotus on matemaattinen toimenpide, joka suoritetaan aineen säilyttämislain ylläpitämiseksi reaktioissa. Asiaa ei ole luotu tai tuhoutunut. Siksi atomien lukumäärän ennen ja jälkeen kemiallisen reaktion on oltava sama, sekä reagenssissa että tuotteissa.
Kemiallisen yhtälön tasapainottamiseksi sinun on laskettava atomit ennen nuolta ja sen jälkeen. Jos numerot ovat samat, se tarkoittaa, että reaktio on tasapainossa. Muutoin nämä numerot on tarpeen sovittaa modifioimalla stoikiometriset kertoimet kokeilun ja virheen perusteella, tämä on yksinkertaisin ja intuitiivisin menetelmä tasapainoon.
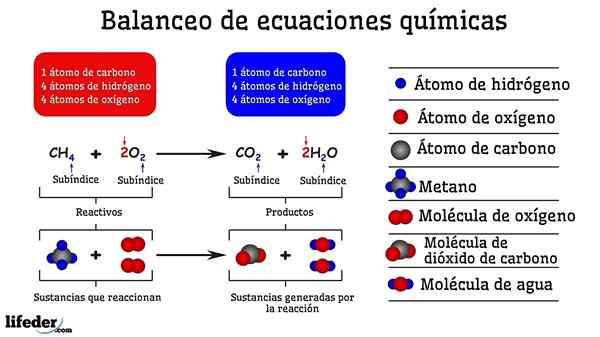
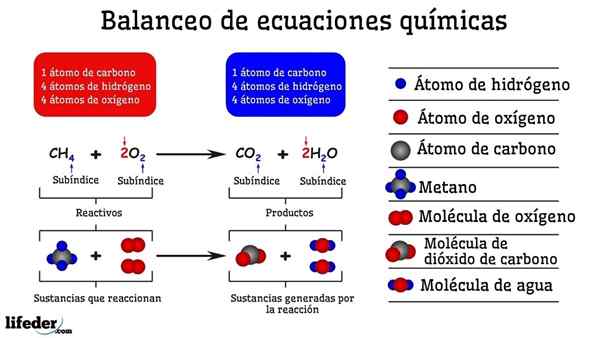 Esimerkki metaanin ja kahden happimolekyylin välisen reaktion kemiallisesta tasapainottamisesta
Esimerkki metaanin ja kahden happimolekyylin välisen reaktion kemiallisesta tasapainottamisesta Kun sitä tasapainotetaan kokeilulla ja virheellä, se on kuin ne olisi poistettu tai lisätty atomeja subbajan yhdellä puolella. Ennen kuin subbaja ei ole suspendoitu vaakasuoraan, kemiallinen yhtälö ei ole täysin tasapainossa. Miltä tahansa puolelta ei voi olla (luo asia) tai vähemmän atomeja (tuhota aine).
Helppo tasapainottaa esimerkkejä yhtälöistä
Seuraavissa esimerkeissä näet tasapainoiset tai helppo tasapainottaa kemiallisia yhtälöitä. Kaikilla on oltava yhteistä, että atomien lukumäärä jokaiselle elementille on sama ennen nuolta ja sen jälkeen, kun kemiallinen yhtälö on tasapainossa.
Elohopeahapetus
2HG +O2 → Hg2JOMPIKUMPI2
Meillä on kaksi elementtiä: elohopea (HG) ja happi (O). Ilmaisemme heidän atomiensa lukumäärän ennen (reagensseja) ja sitten (tuotteita) nuolen:
HG: 2 (vasen) - 2 (oikea)
Se voi palvella sinua: molaarinen fraktio: miten se lasketaan, esimerkkejä, harjoituksiaO: 2 (vasen) - 2 (oikea)
Yhtälö on tasapainossa, koska Hg -atomit ja tai ovat samat nuolen molemmilla puolilla.
Vetypala
H2 + JOMPIKUMPI2 → H2JOMPIKUMPI
Meillä on jälleen kaksi elementtiä: vety (H) ja happi (O). Edellisen vaiheen toistaminen:
H: 2 - 2
O: 2 - 1
Vasemmalla puolella on happi enemmän kuin oikealla. Siksi meidän on lisättävä toinen oikea happi. Tätä varten modifioimme stökiometrisiä kertoimia, jotka ovat numeroita, jotka seuraavat ja edeltävät kaavoja. Jos sijoitamme 2 h: n eteen2Tai antaa meille:
H2 + JOMPIKUMPI2 → 2h2JOMPIKUMPI
H: 2 - 4
O: 2 - 2
Happi ovat tasapainossa. Mutta ei vety. Sinun on lisättävä kaksi vetyään nyt vasemmalle:
2H2 + JOMPIKUMPI2 → 2h2JOMPIKUMPI
H: 4 - 4
O: 2 - 2
Ja yhtälö on lopulta tasapainossa: sama määrä H: tä ja tai ennen ja jälkeen nuolen.
Huomaa, että stoikiometriset kertoimet (2 H: lle2 ja 1 O: lle2) Kerro kaavojen alaosat. Tämä kertolasku antaa meille atomien kokonaismäärän tietylle elementille.
Magnesiumin vähennys
Mg (ei3-A2 + 2li → mg +2lino3
Arvioimme jokaiselle elementille atominumerot:
MG: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
Kemiallinen yhtälö on jo tasapainossa, eikä sitä tarvitse tasapainottaa.
Ratkaisut
Ennen yhtälön tasapainottamista on aina tarpeen vahvistaa, jos se ei ole enää tasapainossa. Se sanoi, jatkamme seuraavaa harjoitusta:
Harjoitus 1
Tasapainoinen tai ei?
Usko2JOMPIKUMPI3 + H2O → Usko (OH)3
Meillä on kolme elementtiä: rauta (usko), vety ja happi. Ehdotus tasapainoyhtälöiden ajankohtana on aloittaa yhtälön vähemmän runsaan elementin atominumerot; joka on yleensä erilainen kuin H ja O. Siten luemme ensin uskon atomit:
Se voi palvella sinua: metyylisalisylaattiUsko: 2 - 1
(OH) alaindeksi 33 Älä kerro vasemmalla olevaa uskoa. H: lle ja o: lle meillä on:
H: 2 - 3
O: 4 - 3
Kaikki elementit ovat epätasapainoisia.
Keinuva
Ennen edes tasapainoa H ja O, meidän on tasapainotettava uskon atomit: vähiten runsas elementti, koska uskoa on tuskin 3, toisin kuin 5 h ja 7 tai 7 tai 7. Sinun on lisättävä sitten usko oikealle:
Usko: 2 - 2
Mikä on yhtä suuri kuin 2 stoikiometrinen kerroin uskon edessä (OH)3. Yhtälö säilyy:
Usko2JOMPIKUMPI3 + H2O → 2fe (OH)3
Usko: 2 - 2
H: 2 - 6
O: 4 - 6
Mutta H ja O tai jatka epätasapainossa. H2Tai osallistua 2 tuntia ja meiltä puuttuu 4 tuntia. Siksi lisäämme vielä kaksi h2Tai meillä on kolme h2JOMPIKUMPI:
Usko2JOMPIKUMPI3 + 3H2O → 2fe (OH)3
Ja arvioimme uudelleen:
Usko: 2 - 2
H: 6 - 6
O: 6 - 6
Huomaa, kuinka he tasapainottavat heitä, kun tasapainotimme H: n. Yhtälö on lopulta tasapainossa.
Harjoitus 2
Tasapainoinen tai ei?
CH4 + JOMPIKUMPI2 → CO2 + H2JOMPIKUMPI
Arvioimme atomien lukumäärän kaikille nykyisille elementeille:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Hiili on tasapainossa, mutta samaa ei tapahdu vedyn ja hapen kanssa. Yhtälö on epätasapainossa.
Keinuva
Koska C on tasapainossa, emme halua modifioida CH: n stökiometrisiä kertoimia4 tai yhteistyö2. Ainakaan periaatteessa.
Keskitämme huomiomme H: ään ja O, etenkin H: iin. Koska? Koska yhtälön näkeminen on helpompaa tasapainottaa h ennen tai. Meidän on lisättävä 2 tuntia oikealle, asettamalla kerroin 2 H: n eteen2JOMPIKUMPI:
CH4 + JOMPIKUMPI2 → CO2 + 2H2JOMPIKUMPI
C: 1 - 1
H: 4 - 4
O: 2 - 4
C ja H ovat tasapainossa. Olemme jättäneet 2 tai vasemmalle. Jos kukin tai2 osallistuu 2 tai lisäämme tai2 ylimääräistä niin, että he ovat 4 tai vasemmalle. Tämä on sama kuin kertoimen 2 asettaminen O: n eteen2-
Voi palvella sinua: RikkioksidiCH4 + 22 → CO2 + 2H2JOMPIKUMPI
C: 1 - 1
H: 4 - 4
O: 4 - 4
Ja yhtälö on lopulta tasapainossa.
Harjoitus 3
Tasapainoinen tai ei?
N2 + H2 → NH3
Arvioimme kaksi elementtiä N ja H:
N: 2 - 1
H: 2 - 3
Yhtälö ei ole tasapainossa.
Keinuva
Aloitamme tasapainon n, elementin erilainen kuin h. Meillä ei ole oikeutta, ja kuten jokainen NH3 Osallistuu 1 n, meidän on lisättävä toinen NH3 Saada 2 n:
N2 + H2 → 2NH3
N: 2 - 2
H: 2 - 6
Ja nyt meiltä puuttuu vasemmisto. Jos jokainen H2 Osallistu 2 tuntia yhtälöön, niin meidän on lisättävä vielä kaksi niin, että niitä on 6 tuntia. Tämä on sama kuin stoikiometrisen kertoimen 3 asettaminen H: n eteen2-
N2 + 3H2 → 2NH3
N: 2 - 2
H: 6 - 6
Ja kemiallinen yhtälö on lopulta tasapainossa.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Kemian librettexts. (23. marraskuuta 2020). Kuinka kirjoittaa tasapainoiset kemialliset yhtälöt. Palautettu: Chem.Librettexts.org
- Wikipedia. (2020). Kemiallinen yhtälö. Haettu: vuonna.Wikipedia.org
- Kemian periaatteet. (S.F.-A. Kemiallisten yhtälöiden kirjoittaminen ja tasapainottaminen. [PDF]. Haettu: Web.Irrottaa.Edu
- Köyhä. (S.F.-A. Kemiallisten yhtälöiden tasapainotus. Palautettu: PHET.Colorado.Edu
- Armando marín b. (S.F.-A. Yleinen kemia: Yhtälöiden tasapainottaminen. [PDF]. Palautettu: DEPA.Fquim.Yksinäinen.MX

