Piilevä lämpö
- 3561
- 293
- Kelly Kilback
Mikä on piilevä lämpö?
Piilevä lämpö on lämmön määrä, joka on absorboida tai irrotettava aine fyysisen kuntoa tai vaiheen muuttamiseksi, ylläpitää vakiolämpötilaa kyseisen prosessin aikana. Toimitettu tai vapautettu lämpö ei ilmene, se ei "tunne" normaalisti lämpötilan vaihtelussa; Siten piilevän lämmön termi.
Piilevä sana tulee latinalaisesta sanasta "latennit", mikä tarkoittaa piilotettua, joten piilevä lämpö käyttäytyy ikään kuin sitä ei ole, kun lämpötila on vakio. Mutta on: tapahtuu, että se kulutetaan kokonaan vaiheen tai fyysisen kunnon vaihdossa.
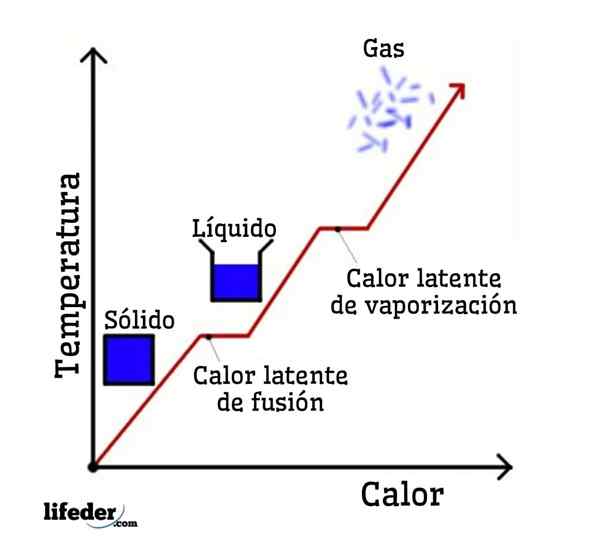
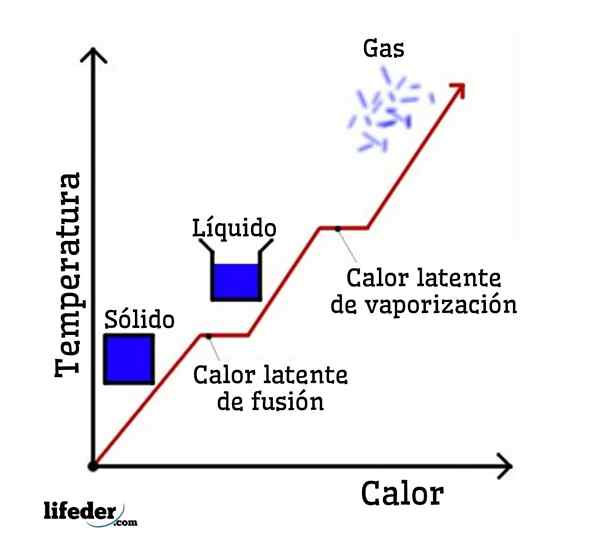
Jos vettä otetaan esimerkkinä, vaihemuutokset ovat seuraavat: Jää (kiinteä) sulaa nestemäiseksi (nestemäiseksi) veteen prosessissa, jota kutsutaan fuusioksi; ja nestemäinen vesi vuorostaan höyrystyy muuttumaan vesihöyryksi (kaasu) prosessiin, jota kutsutaan höyrystykseksi.
Toisaalta vesihöyry jäähdytetään nestemäiseen veteen prosessissa, jota kutsutaan kondensaatioksi; ja nestemäistä vettä tulee jälleen jäätäprosessissa, jota kutsutaan jähmennykseksi.
Jokaisella näistä vaihemuutoksista on liitetty piilevä lämpö, joka voi olla positiivinen (absorptio) tai negatiivinen (vapautus).
Piilevä sulamislämpö
 Vaihda kiinteästä nesteeseen; fuusio
Vaihda kiinteästä nesteeseen; fuusio Se on lämmön määrä, joka on toimitettava tiettyyn määrään kiinteää ainetta, jotta sen fysikaalinen tila voidaan muuttaa kiinteäksi nesteeksi. Fuusion aikana lämpötilan muutosta ei tapahdu, joten vaikka kiinteä aine on perustettu tai sulaa, siitä syntyvä neste on sama lämpötila kuin koko kiinteällä tavalla.
Yleensä tämä lämpö määritetään normaalissa fuusiopisteessä, joka on lämpötila, jossa kiinteä aine alkaa sulautua ilmakehän paineen alaisena. Tässä lämpötilassa on samanaikainen tasapaino tai läsnäolo samaan aikaan kiinteän tilan ja nesteen tila.
Voi palvella sinua: kategorinen muuttuja: Ominaisuudet ja esimerkitKiinteälle tilalle on ominaista kompakti rakenne, joka johtuu suurten energian kemiallisten sidosten olemassaolosta, jotka antavat sille rakenteellisen jäykkyyden. Kiinteän aineen muuntamiseksi nesteeksi nämä vuorovaikutukset on rikki, joten se kulutetaan (absorboi) energiaa tätä tarkoitusta varten.
Tyypillinen esimerkki on, kun vettä, sokeria ja muita aineita muodostetaan jäätelöä. On yleistä huomata, että jäätelö, jos sitä ei kuluteta nopeasti, alkaa sulaa, ts. Tämä tapahtuu, kun jäätelön lämpötila saavuttaa jään sulamispisteen.
Esimerkit
Joitakin esimerkkejä J/G: ssä ilmaistuista piilevistä fuusiolämmitteistä luetellaan; toisin sanoen energia, jonka kiinteä gramma on absorboitava sulamaan sulamispisteessä:
-ICE 334.0 -
-380 alumiini.0 -
-Rikki 38.1
-Kupari 134.0 -
-Etanoli 104.0 -
-Elohopea 11.8
-Kulta 64.5
-Hopea 80.3
-Johtava 24.5
-Volframi 184
Jää imee erittäin lämpöä ei siksi, että sen vuorovaikutukset ovat vahvempia, vaan koska se pystyy poikkeuksellisen hajottamaan lämpöä kiteiden välillä.
Piilevä höyrystymisen lämpö
Se on lämmön määrä, joka absorboi tietyn määrän ainetta siirtyäkseen nestemäisestä tilasta kaasumaiseen tilaan normaalissa kiehumispisteessä. Toisin sanoen neste imee lämpöä, kun se kiehuu ja muuttuu kaasua ilman lämpötilan nousua.
Nesteen rinnassa ainemolekyylit voivat olla vuorovaikutuksessa vetyjen siltojen muodostumisen kanssa ja molekyylien välisten vetovoimien suhteen. Aineen siirtämiseksi nestemäisestä tilasta kaasumaiseen tilaan sinun on voitettava nämä voimat, joten sinun on toimitettava lämpöä.
Herkästä lämmöstä tulee se, joka absorboi nesteen vain sen lämpötilan nostamiseksi, mikä riippuu sen erityisestä lämmöstä. Samaan aikaan piilevää höyrystymislämpöä käytetään sen muuntamiseen suoraan höyryksi, prosessi, joka on paljon helpompaa kiehumispisteessä.
Se voi palvella sinua: Kalibrointikäyrä: Mihin se on, miten se tehdään, esimerkkejäEsimerkit
Alla on esimerkkejä joistakin nesteistä, joiden vastaavilla piilevällä höyrystyslämmöllä on jälleen J/G:
-Etikkahappo 402
-Asetoni 518
-Vesi 2256
-Etyylialkoholi 846
-Rikki 1510
-Bentseeni 390
-Hiilidioksidi 574
-Kloori 293
-Eetteri 377
-Glyseriini 974
-Elohopea 295
-Happi 214
Huomaa nestemäisen veden valtava piilevä lämpö: 1 g nestemäistä vettä (noin 1 ml) on absorboitava 2256 J höyrystääkseen. Nestemäinen vesi hajottaa edelleen lämmön, jonka se saa paljon paremmin verrattuna.
Piilevä jähmetty
Lämpö on irrotettava tietty määrä ainetta siirtyäkseen nestemäisestä tilastaan kiinteään tilaan jähmettymisen tai jäätymisen kohdalla. Jälleen, kunnes neste ei ole täysin jähmettynyt, lämpötila pysyy vakiona.
Jähmähdytysprosessi on käänteinen sulautumisprosessille, joten piilevän jähmettymislämmön arvot ja fuusion piilevän lämmön arvot ovat yhtä suuret, mutta päinvastoin.
Aineen molekyylit nestemäisessä tilassa liikkuvat jonkin verran vapauden vuoksi niiden energian vuoksi. Siksi kiinteän vaiheen siirtymiseksi molekyylien on vapautettava energiaa lämmön muodossa, mikä mahdollistaa suuremman vuorovaikutuksen ainemolekyylien välillä.
Molekyylien välinen vuorovaikutus suosii kiinteän faasin kemiallisten sidosten muodostumista. Esimerkki tästä tapahtuu, kun nestemäinen vesi asetetaan astioihin jääkaapin jääkaapissa. Pakastinuuttelmauutteena nestemäisestä vedestä ja jähmettyy jäämään.
Esimerkit
Alla on joitain esimerkkejä piilevästä jähmettymisestä (j/g) joillekin nesteille:
Voi palvella sinua: Valkoinen reikä: historia, teoria ja miten se muodostuu-Vesi (-334)
-Alumiini (-380)
-Rikki (-38)
-Kupari (-134)
-Etanoli (-104)
Piilevä kondensaatiolämpö
Se on lämmön määrä, joka on vapautettava tai vapautettava tietyltä määrästä ainetta, siirtyä kaasutilasta nestetilaan. Tiivistetty kaasu ja muodostettu neste ylläpitää samaa lämpötilaa kondensaation aikana.
Kondensaatio on höyrystymisen vastainen prosessi. Piilevällä tiivistymislämmöllä on sama arvo kuin piilevä höyrystymislämpö, mutta vastakkaisella merkinnällä ja kiehumispisteessä. Esimerkki tästä on, kun se on kypsennetty ja höyry tiivistyy ruukujen sisäpinta.
Kaasumaiset molekyylit liikkuvat vapaasti heidän energiansa kautta. Siksi niiden on vapautettava energiaa, jotta nestemäisen tilan molekyylien väliset vuorovaikutukset voidaan vahvistaa aineen molekyylien väliin.
Luonnossa on monia muita esimerkkejä vesikondensaatioilmiöstä. Vesihöyry nousee ilmakehässä ja tiivistyy pilvissä vesipisaroiden muodossa.
Autojen lasissa on myös vesipisaroita, veden tiivistymisen tuote varhain aamulla tapahtuvan lämpötilan laskusta johtuen, joka muodostuu niin nimeltään Rocío.
Esimerkit
Lopuksi heidän vastaavat piilevät kondensaatiolämpötilat, jotka ovat jälleen kerran ilmaistuna, joillekin höyryille luetellaan:
-Etikkahappo (-402)
-Asetoni (-518)
-Vesi (-2256)
-Etyylialkoholi (-846)
-Rikki (-1510)
-Bentseeni (-390)
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Walter J. Moore. (1963). Fysikaalinen kemia. Kemiallisessa kinetiikassa. Neljäs painos, Longmans.
- Wikipedia. (2020). Piilevä lämpö. Haettu: vuonna.Wikipedia.org
- Enyclopaedia Britannica -toimittajat. (2020). Piilevä lämpö. Toipunut: Britannica.com
- Tekniikan työkalupakki. (2003). Nesteet: haihtumisen piilevä lämpö. Haettu: Engineeringtoolbox.com
- Luumen oppiminen. (S.F.-A. Vaihemuutos ja vakiintunut lämpö. Toipunut: kurssit.Lumenarning.com

