Berylliumhistoria, rakenne, ominaisuudet, käytöt

- 2466
- 729
- Louis Moen
Hän beryllium Se on metallinen elementti, joka kuuluu jaksollisen taulukon ryhmään 2 tai IIA: lle. Se on ryhmän kevyin emäksinen metalli, ja sitä edustaa BE -symboli. Sen atomi ja kationi ovat myös pienempiä kuin heidän ikäisensä (MG, CA, MR ...).
Epätavallisen kuormitustiheyden vuoksi tätä metallia ei yleensä tapahdu erikseen. He tietävät noin 30 mineraalia, jotka sisältävät sitä, joista on: beryl (3beo · al2JOMPIKUMPI3· 62· 2h2O), Bertrandita (4beo.2SE2.2H2O), El Chrisoberilo (Beal2JOMPIKUMPI4) ja fenaquita (ole2Joo4-A.
 Metallinen beryllpipitas. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Metallinen beryllpipitas. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] La Esmeralda, arvokas kivi, on variantti beryyliä. Puhdas beryllium ei kuitenkaan ole niin silmiinpistävä; Se näyttää vaalealta harmahtavalta kirkkaudesta (ylivoimainen kuva), ja se on saavutettu pepitas- tai drages -muodossa.
Berylliumilla on joukko ominaisia fysikaalisia ominaisuuksia. Sillä on alhainen tiheys; korkea lämpö- ja sähkökäyttäytyminen, samoin kuin sen lämpökapasiteetti ja lämmön hajoaminen; Se ei ole magneettinen metalli; ja sillä on myös sopiva jäykkyyden ja joustavuuden yhdistelmä.
Kaikki nämä ominaisuudet ovat johtaneet siihen, että Beryllium on metalli, jolla on monia sovelluksia, ja sen käytöstä kupariseoksissa työkalujen kehittämiseen, sen käyttöön raketteissa, lentokoneissa, autoissa, ydinreaktorissa, x -rautalaitteissa, resonanssissa ydinmagneettina jne. .
Berylliumilla on 10 tunnettua isotooppia, jotka vaihtelevat 5Olla 14Olla, koska se on 9Olla ainoa vakaa. Se on myös erittäin myrkyllinen metalli, joka vaikuttaa erityisesti hengityselimiin, joten sen käytössä on rajoitus.
[TOC]
Löytösi historia
Beryllium löysi Louis-Nicolas Vauguelin vuonna 1798 Berilo-mineraalin koostumuselementtinä sekä alumiini- ja beryllium-silikaattina.
Myöhemmin saksalainen kemisti Frederic Wöhler, vuonna 1828, onnistui eristämään berylliumin reagoimalla kaliumia berylliumkloridin kanssa platinapotissa.
Samanaikaisesti ja itsenäisesti ranskalainen kemisti Antoine Bussy saavutti myös berylliumin eristyksen. Wöhler ehdotti ensimmäisenä metallin beryllium -nimeä.
Hän sai nykyisen nimensä vuonna 1957, koska hänet tunnettiin aikaisemmin nimellä Glucinium, joidenkin suolojen makean maun vuoksi. Sekaannuksen välttämiseksi muiden makeiden makuyhdisteiden kanssa ja Glucina -nimisen kasvin kanssa päätettiin muuttaa Berylliumin nimi.
Beraly -rakenne
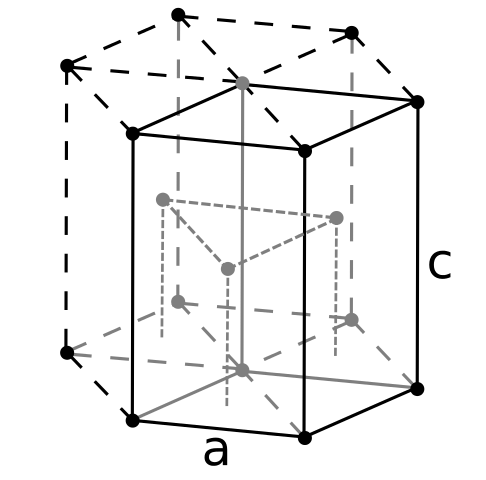 Berly Crign -rakenne. Lähde: Käyttäjä: Dornelf [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Berly Crign -rakenne. Lähde: Käyttäjä: Dornelf [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Beryl on kevyin alkalinoottisia metalleja, on odotettava, että sen atomien tilavuus on pienin kaikista. Berylil -atomit ovat vuorovaikutuksessa keskenään metallisen sidoksen kautta, niin että niiden "elektronien meri" ja ytimien välinen heijastaminen, tuloksena oleva lasirakenne.
Se voi palvella sinua: periódiinihappo (HIO4): Mikä on, rakenne, ominaisuudet, käyttötarkoituksetSitten muodostetaan berylliumin mustat kiteet. Näillä kiteillä on kuusikulmainen rakenne (ylivoimainen kuva), joissa jokaisessa on kuusi sivuneuvoja ja kolme muuta ylä- ja alaspäin.
Mustat kiteet, se on hyödyllinen. Tämä on yksi kompakteimmista rakenteista, joita metalli voi ottaa käyttöön; Ja on järkevää, että niin pienet atomit "puristavat" sekä välttääkseen vähiten tyhjyyden tai reikien lukumäärän niiden välillä.
Elektroninen kokoonpano
1s22s2
Mikä on yhtä suuri kuin 4 elektronia, joista 2 on Valenciasta. Jos 2P: n kiertoradan elektronia. Siten berylliumyhdisteissä voi olla lineaarisia geometrioita, x-be-x; Esimerkiksi eristetty BECL -molekyyli2, Cl-be-cl.
Ominaisuudet
Fyysinen kuvaus
Kiinteä harmaa, kirkas ja hauras väri.
Sulamispiste
1287 ºC.
Kiehumispiste
2471 ºC.
Tiheys
- 1 848 g/cm3 huonelämpötilassa.
- 1,69 g/cm3 sulamispisteeseen (nestemäinen tila).
Atomiradio
Klo 23.00.
Radiokovalenttinen
90 PM.
Atomitilavuus
5 cm3/mol.
Erityinen lämpö
1 824 J/g · mol 20 ºC: n lämpötilassa.
Sulamislämpö
12,21 kJ/mol.
Haihdutuslämpö
309 kJ/mol.
Elektronegatiivisuus
1.57 Pauling -asteikolla.
Vakiopotentiaali
1,70 V.
Äänenopeus
12.890 m/s.
Lämpölaajeneminen
11,3 um/m · K 25 ° C: ssa.
Lämmönjohtokyky
200 w/m · k.
Kemialliset ominaisuudet
Beryllium on peitetty beryylioksidikerroksella (BEEO), joka toimii ilmansuojeluna huoneenlämpötilassa. Berylliumin hapettuminen tapahtuu yli 1000 ºC: n lämpötiloissa, jotka ovat peräisin berylliumoksidista ja berylliumnitridituotteista.
Se on myös vastustuskykyinen typpihapon vaikutukselle 15 m. Mutta se liukenee suolahapon ja alkaliin, kuten natriumhydroksidiin.
Sovellukset
Työkalujen valmistelu
Beryllium muodostaa seoksia kuparilla, nikkelillä ja aluminolla. Erityisesti kupari -seos tuottaa suurta kovuutta ja vastustyökaluja, jotka muodostavat vain 2% seoksen painosta.
Nämä työkalut eivät tuota kipinöitä rautaa lyöessäsi, mikä mahdollistaa niiden käytettäväksi ympäristöissä, joissa on korkea pala kaasua.
Voi palvella sinua: Lämpö: rakenne, ominaisuudet, muodostuminen, esimerkitPienen tiheyden vuoksi sillä on kevyt paino, joka yhdessä jäykkyyden kanssa sallii sen käytön avaruuslentokoneissa, raketteissa, ohjuksissa ja lentokoneissa. Auton osien kehittämisessä on käytetty berylliumilla olevaa seosta. Sitä on käytetty myös Springsin yksityiskohdassa.
Berylliumin seoksille annetun suuren kovuuden vuoksi niitä on käytetty sotilaslentokoneen jarruissa.
Peilata yksityiskohta
Berylliumia on käytetty peilien tuotannossa sen ulottuvuuden stabiilisuuden ja sen kyvyn korkean sydämen vuoksi. Näitä peilejä käytetään satelliitteissa ja palontorjuntajärjestelmissä. Lisäksi käytetään avaruusteleskoopeja.
Ionisoivassa säteilyssä
Beryllium on matalan tiheyselementti, joten sitä voidaan pitää läpinäkyvänä x -rakojen kanssa. Tämä ominaisuus mahdollistaa sen käytön putkien ikkunoiden rakentamisessa.
Samoin berylliumia käytetään radioaktiivisten päästöilmaisimien ikkunoissa.
Magnetismissa tuottavissa joukkueissa
Berylliumin ominaisuuksien joukossa ei ole magneettinen elementti. Tämä mahdollistaa sen käytön magneettikesonanssilaitteiden artikkeleiden rakentamisessa, joissa syntyy suuria intensiteettimagneettikenttiä, minimoimalla kaikki häiriöt.
Ydinreaktorit
Korkean fuusiopisteensa vuoksi se on löytänyt sovelluksen ydinreaktoreihin ja keramiikkaan. Berylliumia käytetään ydinreaktioiden moderaattorina ja neutronien tuottajana:
9Olla + 4Hän (α) => 12C +N (neutroni)
On arvioitu, että miljoonalla beryyli -atomilla, joita pommitetaan a -hiukkasilla, tapahtuu jopa 30 miljoonaa neutronia. Juuri tämä ydinreaktio mahdollisti neutronin löytämisen.
James Chadwick pommitti beryllium -atomeja a -hiukkasilla (HE). Tutkija havaitsi subátomisten hiukkasten vapautumisen ilman sähkövarausta, mikä johti neutronien löytämiseen.
Metalliluokka
Lisää määrä berylliumia metallien pinnalle, joka voidaan hapettua, antaa tietyn suojan. Esimerkiksi magnesiumin syttyvyys vähenee ja hopeaseosten kirkkaus on pitkittynyt.
Missä se sijaitsee?
Beryliä löytyy pegmatiitista, liittyy kiille, maasälpä ja kvartsi. Käyttämällä vaahdotustekniikkaa, on mahdollista erottaa beryyli- ja maasälpä -seos. Myöhemmin maasälpä ja beryyli on keskittynyt ja altistetaan käsittely kalsiumhypokloriitissa.
Se voi palvella sinua: erot orgaanisten ja epäorgaanisten yhdisteiden välilläSeuraava käsittely rikkihapolla ja kaliumsulfonaatilla, laimennuksen avulla beryylivalo saavutetaan, erottaen sen maasälusta.
Beryyli käsitellään natriumfluorosyylicaatilla ja soodalla 770 ºC: n nopeudella natriumfluoroberilaatin, alumiinioksidin ja piin dioksidin muodostamiseksi. Sitten natriumhydroksidihydroksidiflorroberile -liuoksen berylliumhydroksidi saostuu.
Berylliumfluoridi muodostetaan reagoimalla beryylihydroksidi ammoniakkisen vetyfluoridin kanssa, tuottaen ammoniumammoniumia. Tätä kuumennetaan berylliumfluoridin muodostamiseksi, jota käsitellään kuumalla magnesiumilla berylliumin eristämiseksi.
Riskejä
Beryllium hienoksi jaettuna metallina, liuosten, kuivapölyn tai savun muodossa, on erittäin myrkyllinen ja voi tuottaa ihottumaa. Suurin toksisuus tuotetaan kuitenkin hengittämällä.
Alun perin beryllium voi indusoida yliherkkyyttä tai allergiaa, josta voi tulla berylliumin bellioosi tai krooninen sairaus (CBD). Tämä on vakava sairaus, jolle on ominaista keuhkojen kapasiteetin väheneminen.
Akuutti sairaus on harvinaista. Kroonisessa sairaudessa koko kehossa on farulooman muodostuminen, etenkin keuhkoissa. Krooninen bellioosi aiheuttaa asteittaista hengenahdistusta, yskää ja yleistä heikkoutta (Asthenia).
Akuutti bellioosi voi olla tappava. Bellioosissa tapahtuu asteittainen hengityselinten menetys, koska hengitysteiden virtaus on tukkeutunut hengitysteiden ja verenpaineen hapettumisen vähentyessä.
Viitteet
- Kuninkaallinen kemian yhdistys. (2019). Beryllium. Palautettu: RSC.org
- Kansallinen bioteknologiatietojen keskus. (2019). Beryllium. Pubchem -tietokanta. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Helmestine, Anne Marie, PH.D -d. (15. maaliskuuta 2019). Beryllium tosiasiat. Toipunut: Admingco.com
- Wikipedia. (2019). Beryllium. Haettu: vuonna.Wikipedia.org
- Lentech b. V. (2019). Beryllium-be. Toipunut: lentech.com
- Yritysmateriaali. (2019). Opi elementistä, jonka beryllium on palautettu: beryllium.com
- D -d. Michaud. (12. huhtikuuta 2016). Beryllium -prosessointi- ja uuttamisongelma. 911 metallurgisti. Toipunut: 911metallurgist.com
- Timothy p. Hanusa. (5. tammikuuta 2016). Beryllium. Encyclopædia britannica. Toipunut: Britannica.com
- Lue. Uusi mies. (2014). Beryllium -sairaus. MSD -käsikirja. Palautettu: msdmanualit.com
- « Urheilupsykologian historia, tavoitteet ja profiilit
- Sosiaalinen globalisaatio Sosiaalinen ulottuvuus, edut ja esimerkit »

