Kalsiumbikarbonaatti

- 1533
- 77
- Mr. Clifford Kshlerin
 Kalsiumbikarbonaatti on bikarbonaattiryhmän epäorgaaninen suola
Kalsiumbikarbonaatti on bikarbonaattiryhmän epäorgaaninen suola Mikä on kalsiumbikarbonaatti?
Hän kalsiumbikarbonaatti Se on epäorgaaninen suola, jossa on CA -kemiallinen kaava (HCO3-A2. Se on peräisin kalsiumkarbonaatin luonteesta, joka on läsnä kalkkikivessä ja mineraalikivissä, kuten kalsiitissa.
Kalsiumbikarbonaatti liukenee enemmän veteen kuin kalsiumkarbonaatti. Tämä ominaisuus on sallinut karst -järjestelmien muodostumisen kalkkikivikiviin ja luolien jäsentämiseen.
Halkeamien ylittävä pohjavesi on kyllästetty hiilidioksidin siirtymisessä (Co CO2-A.
Nämä vedet heikentävät kalkkikivikiviä, jotka vapauttavat kalsiumkarbonaattia (Caco3) Kalsiumbikarbonaatti muodostuu seuraavan reaktion mukaan:
Varas3(s) +Co2(g) +h2Tai (l) => CA (HCO3-A2(AQ)
Tämä reaktio tapahtuu luolissa, joissa erittäin kovat vedet ovat peräisin. Kalsiumbikarbonaatti ei ole kiinteässä tilassa, vaan vesiliuoksessa yhdessä CA: n kanssa2+, Bikarbonaatti (HCO3-) ja karbonaatti -ioni (CO32--A.
Seuraavaksi vähentämällä hiilidioksidin kylläisyyttä vedessä, käänteinen reaktio tapahtuu, ts. Kalsiumbikarbonaatin muuntaminen kalsiumkarbonaatiksi:
CA (HCO3-A2(aq) => co2 (g) +h2Tai (l) +caco3 (S)
Kalsiumkarbonaatti on vähän liukoinen veteen, tämä aiheuttaa sen saostumisen kiinteänä. Aikaisempi reaktio on erittäin tärkeä luolien stalaktiittien, stalagmiittien ja muun paksuuden muodostumisessa.
Nämä kiviset rakenteet muodostuvat vesipisaroista, jotka putoavat luolien katosta. Caco3 Läsnä vesipisarissa kiteytetään edellä mainittujen rakenteiden muodostamiseksi.
Se tosiasia, että kalsiumbikarbonaattia ei löydy kiinteässä tilassa.
Kalsiumbikarbonaatin rakenne
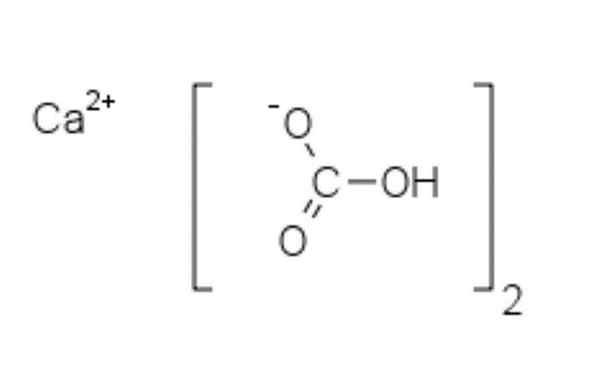 Kalsiumbikarbonaatin kemiallinen rakenne
Kalsiumbikarbonaatin kemiallinen rakenne Yläkuvassa esitetään kaksi HCO -anionia3- ja kationi2+ vuorovaikutuksessa sähköstaattisesti. CA2+, Kuvan mukaan sen tulisi sijaita keskellä, koska niin HCO3- He eivät hylkää keskenään negatiivisten maksujensa vuoksi.
Negatiivinen kuorma HCO: ssa3- Se muuttaa kahden happiatomin välillä resonanssilla karbonyyli C = O-ryhmän ja C-O-linkin välillä-; ollessa yhteistyössä32-, Tämä siirretään kolmen happiatomin välillä, koska C-O-sitoutuminen on suojaamaton ja voi saada negatiivisen resonanssikuorman.
Se voi palvella sinua: difenyyliamiiniNäiden ionien geometrioita voidaan pitää kalsiumpallona, jota ympäröivät litteät karbonaattikolmiot, joilla on hydrattu pää. Koko -suhteen kannalta kalsium on huomattavasti pienempi kuin HCO -ionit3-.
Vesipitoiset ratkaisut
Kalsiumbikarbonaatti Et voi muodostaa kiteisiä kiinteitä aineita, ja se koostuu todella tämän suolan vesipitoisista liuoksista. Niissä ionit eivät ole yksin, kuten kuvassa, mutta H -molekyylien ympäröimä2JOMPIKUMPI.
Jokaista ionia ympäröi hydraatiopallo, joka riippuu liuenneen lajin metallista, napaisuudesta ja rakenteesta.
CA2+ Se koordinoi veden happiatomien kanssa muodostaen Aquocomplex, CA (OH2-An2+, missä N: tä pidetään yleensä kuudeksi; eli "vesipitoinen oktaedroni" kalsiumin ympärillä.
Vaikka HCO -anionit3- Ne ovat vuorovaikutuksessa hyvin joko vety silloilla (tai2Yhdessä2) tai veden vetyatomien kanssa negatiivisen kuorman suuntaan (hoco2- H-OH, dipolin vuorovaikutus).
Nämä vuorovaikutukset CA: n välillä2+, HCO3- Ja vesi on niin tehokasta, että ne tekevät kalsiumbikarbonaatista erittäin liukenevan siihen liuottimeen; Toisin kuin kalsiumkarbonaatti (Caco3), jossa sähköstaattiset nähtävyydet CA: n välillä2+ ja co32- Ne ovat erittäin vahvoja, saostaen vesiliuoksen.
Veden lisäksi on co -molekyylejä2 ympärillä, jotka reagoivat hitaasti lisäämään HCO: ta3- (PH -arvoista riippuen).
Hypoteettinen kiinteä
Toistaiseksi ionikoot ja kuormat kalsiumbikarbonaatissa tai veden läsnäolossa selitetään miksi kiinteää yhdistettä ei ole; Eli puhtaat kiteet, joille voidaan karakterisoida x -kristallografia. Kalsiumbikarbonaatti ei ole muuta kuin ionit.
Kyllä ca2+ ja HCO3- He voisivat eristää itsensä vedestä välttäen seuraavaa kemiallista reaktiota:
CA (HCO3-A2(aq) → caco3(s) + Co2(g) + h2Tai (l)
Sitten nämä voitaisiin ryhmitellä valkoiseen kiteiseen kiinteään kiinteään kiinteään kiinteisiin mittasuhteisiin 2: 1 (2HCO3/1ca).
Voi palvella sinua: 30 esimerkkiä kemiallisista suspensioistaSen rakenteesta ei ole tutkimuksia, mutta sitä voitaisiin verrata natriumbikarbonaatin rakenteeseen (magnesiumbikarbonaattina, MG (HCO3-A2, Se ei myöskään ole kiinteä) tai kalsiumkarbonaatin kanssa.
Stabiilisuus: Natriumbikarbonaatti (NAHCO3) vs. Kalsiumbikarbonaatti (CA (HCO3-A2-A
Natriumbikarbonaatti kiteytyy monokliinisessä järjestelmässä ja kalsiumbikarbonaattia trigonaalisissa (kalsiitti) ja ortorromisissa järjestelmissä (aragoniitti).
Jos na korvataan+ CA: lle2+, Kiteinen verkko destabilisoidaan suuremmalla kooterolla; eli na+ Pienemmäksi se muodostaa vakaamman lasin HCO: n kanssa3- verrattuna CA: hon2+.
Itse asiassa CA (HCO3-A2(AQ) tarvitsee vettä haihtumiseen, jotta sen ionit voidaan ryhmitellä lasiin; Mutta tämän kiteinen verkko ei ole riittävän vahva tekemään sitä huoneenlämpötilassa. Vettä kuumennettaessa hajoamisreaktio tapahtuu (yhtälö ylhäältä).
Olla ioni na+ Liuoksessa tämä muodostaisi lasin HCO: n kanssa3- ennen sen lämpöhajoamista.
Syynä siihen, miksi kalsiumbikarbonaatti ei kitey (teoreettisesti), johtuu ionisemien radioiden eroista tai niiden ionien kokoista, jotka eivät voi muodostaa stabiilia kiteitä ennen niiden hajoamista.
Kalsiumbikarbonaatti (CA (HCO3-A2-A vs. kalsiumkarbonaatti (Caco3-A
Jos toisaalta H lisätään+ Kalsiumkarbonaatin kiteisiin rakenteisiin ne muuttaisivat dramaattisesti niiden fysikaalisia ominaisuuksia. Ehkä heidän sulatuspisteet putoavat merkittävästi, ja jopa kiteiden morfologiat modifioituvat.
Fysikaaliset ja kemialliset ominaisuudet
Kemiallinen kaava
CA (HCO3-A2
Molekyylipaino
162.11 g/mol
Fyysinen tila
Se ei näy kiinteässä tilassa. Sitä löytyy vesipitoisesta liuoksesta, ja kun lämpöä levitetään haihtumiseen, siitä tulee kalsiumkarbonaatti.
Vesiliukoisuus
16,1 g/100 ml 0º C: ssa; 16,6 g/100 ml lämpötilassa 20º C ja 18,4 g/100 ml 100º C.
Nämä arvot osoittavat vesimolekyylien suuren affiniteetin kalsiumbikarbonaatin ioneilla, kuten edellisessä osassa selitetään. Samaan aikaan vain 15 mg kalsiumkarbonaattia liukenee litraan vettä, mikä heijastaa sen voimakkaita sähköstaattisia vuorovaikutuksia.
Koska kalsiumbikarbonaatti ei voi muodostaa kiinteää, sen liukoisuutta ei voida määrittää kokeellisesti.
Kuitenkin ottaen huomioon CO: n luomat olosuhteet2 Kalkkikiveä ympäröivään veteen liuotettu, T -lämpötilaan liuenneen kalsiumimassa voitiin laskea; Massa, joka olisi yhtä suuri kuin kalsiumbikarbonaatin pitoisuus.
Voi palvella sinua: Benzyiinihappo: synteesi, siirtyminen ja käyttötarkoituksetEri lämpötiloissa liuenneen massa kasvaa, kuten arvoissa 0, 20 ja 100º C. Sitten näiden kokeiden mukaan määritetään, kuinka suuri osa kalsiumbikarbonaatista Se liukenee kalsiumkarbonaatin läheisyyteen, vesipitoiseen väliaineeseen, joka on kaasutettu CO: n kanssa2.
Kun Co pakenee2 Kaasumainen, kalsiumkarbonaatti saostuu, mutta ei kalsiumbikarbonaattia.
Fuusio- ja kiehumispisteet
CA: n kristalliverkko (HCO3-A2 Se on paljon heikompi kuin Caco3. Jos se voitaisiin saada kiinteässä tilassa ja mitata lämpötila, jossa se sulaa lähteellä, arvo varmasti saadaan selvästi alle 899º C. Samoin saman tulisi odottaa kiehumispisteen määrittämisessä.
Palamispiste
Se ei ole polttoainetta.
Riskejä
Koska tätä yhdistettä ei ole kiinteästi, on epätodennäköistä, että se edustaa riskiä manipuloida sen vesipitoisia liuotteita, koska molemmat ionit CA2+ Kuin HCO3- Ne eivät ole haitallisia pienille pitoisuuksille; Ja siksi suurin riski, joka olisi sellaisten ratkaisujen nauttiminen, voi johtua vain vaarallisesta kalsiumiannosta.
Jos yhdiste muodosti kiinteän, jopa fyysisesti erilaista kuin caco3, Sen myrkylliset vaikutukset eivät voineet ylittää yksinkertaista epämukavuutta ja resektiota fyysisen kosketuksen tai hengityksen jälkeen.
Sovellukset
- Kalsiumbikarbonaattiratkaisuja on käytetty jo pitkään muinaisten paperien, erityisesti taideteoksien tai historiallisesti tärkeiden asiakirjojen pesemiseen.
- Bikarbonaattiratkaisuja on käytetty osteoporoosin ehkäisyssä. Yhdessä tapauksessa yhdessä tapauksessa on havaittu sivuvaikutuksia, kuten hyperkalsemia, metabolinen alkaloosi ja munuaisten vajaatoiminta.
- Kalsiumbikarbonaatti annetaan toisinaan laskimonsisäisesti hypokalemian masennusvaikutuksen korjaamiseksi sydämen toimintaan.
- Sitä käytetään vatsan happamuuden rauhoittamiseen.
Viitteet
- Wikipedia (2018). Kalsiumbikarbonaatti. Otettu: sisään.Wikipedia.org
- Sirah Dubois (3. lokakuuta 2017). Mikä on kalsiumbikarbonaatti? Toipunut: Livestrong.com
- Tiedekasvatuskeskus (2018). Karbonaattikemia. Toipunut.org.NZ
- Pubchem (2018). Kalsiumbikarbonaatti. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus

