Kaliumbiftalaatit rakenne, nimikkeistö, käyttö, riskit
- 2753
- 342
- Juan Breitenberg V
Hän kaliumbiftalaatti Se on kemiallinen, kiinteä, valkoinen, liukoinen yhdiste, joka on kaupallisesti erittäin puhtaustilassa. Sitä käytetään ensisijaisena kuviona liuosten standardisoimiseksi happo-emästen pätevyydessä; Sitä käytetään myös puskuriliuoksena, jotta liuosten pH on stabiili.
Se on vakaa, ei -kygroskooppinen yhdiste, joka helpottaa liuoksen valmistusta, koska se ei absorboi vettä raskaan prosessin aikana. Se voidaan valmistaa reaktiolla valohapon ja KOH -liuoksen välillä, jossa ftaalihappomolekyylin vety korvataan kaliumiatomilla.
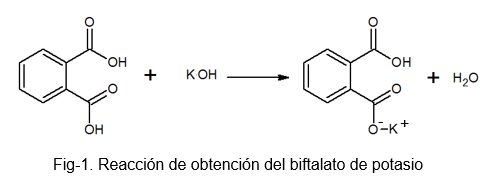
Kaliumbiftalaatti vastaanottaa tämän nimen, koska sen molekyylissä on hiukan happama vety. Tämä vety löytyy -oH -ryhmästä, joka sijaitsee aivan karbonyyliryhmän vieressä, joka on osa karboksyyliä, joka ei reagoi. Tämän tyyppisiä suoloja tunnetaan happasuoloina, koska ne eivät ole täysin neutraaleja.
[TOC]
Kemiallinen rakenne

Kaava
C6H4COOHCOOK = C8H5 Koolainen4
Nimikkeistö
- Kaliumbiftalaatti.
- Kaliumhappoftalaatti.
- Kaliumvety.
Ominaisuudet
Tiheys
1 636 g/ml.
Moolimassa
204.22 g/mol.
Liukoisuus
Vesi- ja alkoholi.
Sulamispiste
295 ° C hajoamisen kanssa.
Näkökohta
Valkoinen -valkoinen kiinteä.
Tietty paino
1,64 gr/cm3.
Kaliumbiftalaattijohdannainen tutkimus
Derichrografiset mittaukset ovat osoittaneet, että kaliumbiftalaatin hajoaminen alkaa välillä 190 ° C -200 ° C, ja ei -hygroskooppinen valmistus voidaan valmistaa välillä 100 ° C -150 ° C.
Hajoaminen etenee kolmessa vaiheessa, joiden nopeus riippuu lämpötilan nousun nopeudesta: dipbottiumftalaatti muodostetaan ensin, phtaalinen anhydridi ja vesi eliminoidaan.
Voi palvella sinua: kalsiumkloridi (CACL2)Valostamuutokset voidaan saada myös johdannaisesta, tämä tuottaa tietoja lämmön hajoamisen lisämekanismista ja näytteen tilan muutoksista.
Käyttö ja sovellukset
Tätä yhdistettä käytetään analyyttisessä kemiassa happo-emäs titraamisessa tai arvioinnissa ensisijaisena standardisointikuviona eri yhdisteiden liuoksien valmistuksessa.
Emäksen standardisointi (alkal = NaOH)
NaOH -liuosta valmistettaessa ei voida taata, että pitoisuus, jolla liuos pysyy, on oikea; Tämä johtuu siitä, että NaOH on erittäin hygroskooppinen kiinteä aine (absorboi ilmaa ilmasta), ja sen punnitsemiseksi se pysyy jonkin verran kosteuden kanssa, mikä tekee aineen määrästä, joka ei ole optimaalisin.
Kun liuos on valmistettu.
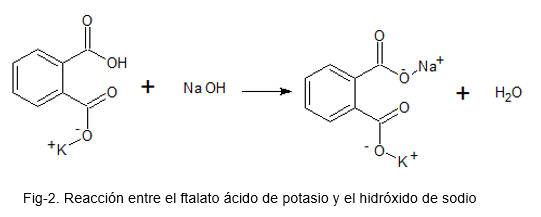
Tätä varten liuos valmistetaan kaliumhappoftalaatilla, joka on ensisijainen kuvio (sen korkean stabiilisuuden vuoksi); Muutamia tippoja fenolftaleiinihappo-emäsindikaattoria lisätään ja NAOH-liuos otsikkona lisätään, kunnes vaaleanpunainen väri on läsnä kaliumhappoftalaatiliuoksessa.
Saatujen tietojen avulla tehdään asiaankuuluvat laskelmat NaOH: n todellisen pitoisuuden löytämiseksi.
Seuraava kuva kuvaa kemiallista reaktiota kaliumhappoftalaatin ja natriumhydroksidin välillä.

Puskuriliuoksena pH: n määrittämisessä
Puskuri- tai puskuriliuos on se, joka muodostaa sekä happo- että happasuola, tämä aiheuttaa sen olosuhteissa siten, että pH -arvo ei muutu, kun lisätään pieniä määriä happoa tai emästä.
Voi palvella sinua: gravimetria: gravimetrinen analyysi, menetelmät, käytöt ja esimerkitRiskejä
- Palonaltistutus. Kuten useimpien orgaanisten kiinteiden aineiden kohdalla, on mahdollista, että tulipalo korkeissa lämpötiloissa tai kosketuksella sytytyslähteen kanssa voi tapahtua.
- Hieno pöly dispergoitunut ilmaan riittävästi pitoisuuksia ja sytytyslähteen läsnä ollessa vaarallisen pölyn räjähdyksen potentiaali.
- Se on vakaa aine huoneenlämpötilassa ja riittävissä säilytysolosuhteissa. Liiallista lämpöä ja kosteutta tulisi välttää.
- Se voi olla yhteensopimattomia vahvojen hapettimien, kuten typpihapon kanssa.
- Hajoaminen voi muodostaa myrkyllisiä hiilioksideja.
Terveyden suhteen
- Tahattomalla nauttimisella se voi aiheuttaa oksentelua, ripulia ja ärsytystä kalvoissa niiden happamuuden vuoksi.
- Hengittämällä se aiheuttaa ärsytystä hengitysteissä ja yskä.
- Iholle se aiheuttaa ärsytystä.
- Silmissä se aiheuttaa ärsytystä, punoitusta ja kipua.
- Katsottaan, että se ei ole syöpää aiheuttava, teratogeeninen tai mutageeninen aine.
Ensiapu
- Pese silmät runsaalla vedellä, poista hidas, jos ne kuljetetaan ja anna veden kulkea silmien läpi ilman, että niitä kosketetaan käsiä.
- Jos ihon kanssa oli kosketusta, poista puvut ja jalkineet, pese runsaalla vedellä ja pese vaatteet erittäin hyvin ennen kuin käytät uudelleen.
- Nielemisen tapauksessa välttää oksentelun provosointia, juomavettä.
- Hengitysten tapauksessa vie henkilö hengittämään raikasta ilmaa; Vaikea hengitys, toimittaa happea.
- Kaikissa tapauksissa pyydä kiireellistä lääketieteellistä apua.
- Vuotojen tai vuotojen tapauksessa kerää tuote puhtaaseen astiaan ja yritä saada pöly leviämään.
Se voi palvella sinua: mitkä ovat negatiiviset vaikutukset veden liukoisuuteen?Henkilökohtaiset suojelutoimenpiteet
- Pysy poissa paikasta, jossa juomia, ruokaa ja rehua varastoidaan (lemmikkieläinten ruoka).
- Käytä anti -pölyhaskeja, neopreeniä tai PVC -käsineitä. Tällä hetkellä käytetään nitriilikäsineitä.
- Käytä riittäviä vaatteita, jotka peittävät suurimman osan vartalosta, mukaan lukien peitetyt saappaat tai kengät ja turvalasit.
- Paikallista pakokaasun tuuletusta suositellaan, ilma -poistojärjestelmällä ottaen huomioon vallitseva tuulen suunnan.
- Tuote on sekoittumassa vedessä, se ei imeytyy maahan, se ei ole bioakumuloiva tai biohajoava, sen ei odoteta vaikuttavan vesielämään. Sen hylkäämishetkellä se on kuitenkin tehtävä erikoistuneen henkilöstön avulla: älä hylkää viemäröitä.
- Säilytä oranssia/vihreää aluetta, tuore kuiva ja tuuletettu paikka ja erotettu yhteensopimattomasta materiaalista.
Viitteet
- Merck, (S.f), Merckmillipore.com
- Chang R.,(1992), Chemistry, (neljäs painos), Meksiko, McGraw-Hill-Amerikanvälinen Meksikosta.A, C: stä.V
- Meyer -kemian reagenssit (S.f), Turvallisuustietoloma.com.MX
- Belcher, r.,Erdey, L.,Paulik, f.,Liptoy.G.,(Heinäkuu 1960), kaliumvetyftateftalaatti tulipalo, Tiede, Osa 5, numero 1, Sivut 53-57, org/10.1016/0039-9140 (60) 80205-6

