Boron historia, ominaisuudet, rakenne, käyttää

- 3505
- 34
- Kelly Kilback
Hän boori Se on ei -metallinen elementti, joka johtaa jaksollisen taulukon ryhmää 13 ja on esitetty kemiallisella symbolilla B. Hänen atomiluku on 5, ja se on ainoa ei -metallinen elementti ryhmässään; Vaikka jotkut kemikaalit pitävät sitä metalloidina.
Se esitetään mustanruskeana jauheena ja on 10 ppm: n osassa suhteessa maankuoreen. Siksi se ei ole yksi runsasosista elementtejä.
 Boro -näyte, jonka puhtaus on noin 99%. Lähde: Alajhasha [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Boro -näyte, jonka puhtaus on noin 99%. Lähde: Alajhasha [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Se on osa useita mineraaleja, kuten booraksia tai natriumboraattia, tämä on yleisin boorin mineraali. Siellä on myös Kurnite, toinen natriumporate -muoto; Colemanite tai kalsiumboraatti; ja ulexite, natrium ja kalsium borato.
Boratot uutetaan Yhdysvalloissa, Tiibetissä, Kiinassa ja Chilessä, ja maailman tuotanto on noin kaksi miljoonaa tonnia vuodessa.
Tässä elementissä on kolmetoista isotoopia, mikä on runsain yksitoistaB, joka muodostaa 80,1% boorista ja 10B, joka muodostaa jäljellä olevan 19,9%.
Boori on välttämätön jälki kasveille, puuttuu joidenkin elintärkeiden kasviproteiinien synteesiin ja myötävaikuttaa veden imeytymiseen. Nisäkkäissä se näyttää olevan välttämätöntä luun terveydelle.
Vaikka boorin löysi vuonna 1808 englantilainen kemisti Sir Humphry Davy, ja ranskalaiset kemistit Jacques Thérnard ja Joseph Gay-Lussac, Kiinan aikakauden alusta lähtien käytettiin booraksia Enmelin keramiikan laatimisessa.
Boorilla ja sen yhdisteillä on monia käyttötarkoituksia ja sovelluksia, niiden käytöstä elintarvikkeiden säilyttämisessä, etenkin margariinissa ja kaloissa, kunnes ne voivat käyttää aivojen, virtsarakon, eturauhasen ja muiden elinten ja muiden elinten syöpäkasvaimien hoidossa.
Boori ei ole kovin liukeneva veteen, mutta sen yhdisteet ovat. Tämä voi olla boorin pitoisuusmekanismi, samoin kuin myrkytyslähde elementin kanssa.
[TOC]
Historia
Tausta
Koska etäajat, ihminen on käyttänyt booriyhdisteitä erilaisissa toiminnoissa. Kiinassa käytettiin El Boraxia, mineraalia, joka tunnetaan nimellä Tincal.C. emalikeramiikan kehittämisessä.
Persian alkemisti (865-925) mainitsi ensimmäisen maininnan Boro-yhdisteistä. Rhazes luokitteli mineraalit kuudessa luokassa, joista yksi oli borocies, joka sisälsi booria.
Agricola, noin 1600, ilmoitti booraksin käytön virtauksena metallurgiassa. Vuonna 1777 tunnistettiin boorihapon läsnäolo kuumin lähteiden virtaan lähellä Firenzea.
Elementin löytäminen
Humphry Davy havaitsi booraksiliuoksen elektrolyysin kautta mustan sakan kertymisen yhdessä elektrodissa. Hän lämmitti myös boorioksidin (B2JOMPIKUMPI3) Kaliumin kanssa, tuottaen mustanruskean jauheen, joka oli boorin tunnettu muoto.
Gay-Lussac ja Thénard vähensivät boorihappoa korkeissa lämpötiloissa raudan läsnä ollessa boorin tuottamiseksi. He osoittivat myös käänteisen prosessin, toisin sanoen, missä boorihappo on boorihapon tuote.
Tunnistaminen ja eristäminen
Jöns Jakob Berzelius (1827) saavutti Boron tunnistamisen uudeksi elementiksi. Vuonna 1892 ranskalainen kemisti Henri Moissan onnistui tuottamaan booria 98%: n puhtaudella. Vaikka todetaan, että booria tuotti puhtaasti amerikkalainen kemisti Ezekiel Weintraub, vuonna 1909.
Ominaisuudet
Fyysinen kuvaus
Kiteinen kiinteä tai musta-ruskea amorfinen jauhe.
Voi palvella sinua: Peroksidit: Ominaisuudet, nimikkeistö, käyttötarkoitukset, esimerkitMoolimassa
10 821 g/mol.
Sulamispiste
2076 ºC.
Kiehumispiste
3927 ºC.
Tiheys
-Neste: 2,08 g/cm3.
-Kiteinen ja amorfinen 20 ºC: lla: 2,34 g/cm3.
Sulamislämpö
50,2 kJ/mol.
Höyrystyslämpö
508 kJ/mol.
Molaarinen kalorikapasiteetti
yksitoista.087 J/(mol · k)
Ionisaatioenergia
-Ensimmäinen taso: 800.6 kJ/mol.
-Toinen taso: 2.427 kJ/mol.
-Kolmas taso: 3.659,7 kJ/mol.
Elektronegatiivisuus
2.04 Pauling -asteikolla.
Atomiradio
90 PM (empiirinen).
Atomitilavuus
4,16 cm3/mol.
Lämmönjohtokyky
27,4 W/M.K -k -
Sähkövastus
~ 106 Ω.M (20ºC: ssa).
Korkeat lämpötilat Boron on hyvä sähköjohdin, mutta ympäristön lämpötilassa siitä tulee melkein eristys.
Kovuus
~ 9,5 Mohs -asteikolla.
Reaktiivisuus
Suolahappo ei vaikuta booriin kiehumislämpötilassa. Kuuma typpihappo muuntaa sen kuitenkin boorihapoksi (H3Bo3-A. Boro käyttäytyy kemiallisesti kuin ei -metalli.
Reagoi kaikkien halogeenien kanssa trihalurosille, erittäin reaktiiviseksi. Näillä on yleinen kaava BX3, Missä x edustaa halogeenia.
Se yhdistetään useisiin elementteihin, jotka ovat peräisin Borurosista. Jotkut heistä ovat suuremman kovuuden aineita; Esimerkiksi boorinitride (BN). Boori yhdistetään happea booritrioksidin muodostamiseksi.
Elektroninen boorirakenne ja kokoonpano
Boorin linkit ja rakenneyksiköt
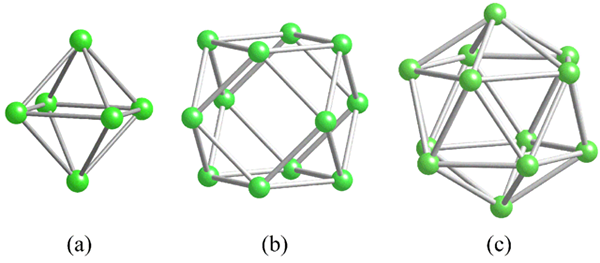 Boorin yhteisten rakenneyksiköiden geometriat. Lähde: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Boorin yhteisten rakenneyksiköiden geometriat. Lähde: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Ennen boorirakenteiden (kiteisiä tai amorfisia) käsittelemistä on välttämätöntä pitää mielessä, kuinka heidän atomit voidaan yhdistää. B-B-linkki on kovalenttisessa olemuksessa; Ei vain, mutta koska luonnollisesti borotomilla on elektroninen puute, he yrittävät toimittaa sen linkilleen tavalla tai toisella.
Boorissa on erityinen kovalenttinen sidos: kolmen keskuksen ja kahden elektronin, 3C2e. Täällä kolmella booriatomilla on kaksi elektronia ja määrittele kolmio, yksi monista niiden rakenteellisista polyhedrosista löytyvistä kasvoista (ylivoimainen kuva).
Vasemmalta oikealle meillä on: Octaedro (A, B6), Cuboctaedro (b, b12), Ja isokasite (c, b12 myös). Kaikilla näillä yksiköillä on ominaisuus: ne ovat köyhiä elektroneissa. Siksi heidän on yhdistettävä kovalenttisesti keskenään; Ja tulos on yllättävä linkkipuolue.
Näiden polyhedrosten jokaisessa kolmiossa 3C2E -linkkiä on läsnä. Muutoin ei voitu selittää, kuinka boori, joka kykenee muodostamaan vain kolme kovalenttisia sidoksia Valencia Link -teorian mukaan, voi olla jopa viisi linkkiä näissä monihäiriöyksiköissä.
Boorirakenteet koostuvat sitten näiden yksiköiden järjestelystä ja toistosta, jotka lopulta määrittelevät kristallin (tai amorfisen kiinteän aineen).
Boro α-Romboédrico
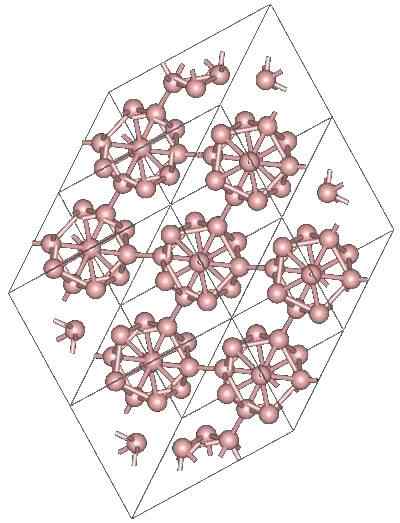 Α-romboédrico-boorialotrooppisen kiteinen rakenne. Lähde: MaterialScientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Α-romboédrico-boorialotrooppisen kiteinen rakenne. Lähde: MaterialScientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Boro voi olla muita polyhedraalisia yksiköitä, samoin kuin A -yhdiste vain kahdella atomilla, B2; boorin "linja", joka on kytkettävä muihin atomeihin sen korkean elektronisen puutteen jälkeen.
Icosaedro on ylivoimaisesti boorin edullinen yhtenäisyys; Se, joka tuntuu paremmalta. Esimerkiksi ylemmässä kuvassa on arvostettu kuinka nämä B -yksiköt12 Ne kietoutuvat boor-a: n rhomboedrisen kiteen määrittelemiseksi.
Jos jokin näistä icosaedrosista haluaisi eristää, se olisi monimutkainen tehtävä, koska niiden elektroninen puute pakottaa heidät määrittelemään kide, jossa kukin tarjoaa elektronit, joita muut naapurit tarvitsevat.
Β-Romboédrico-boori
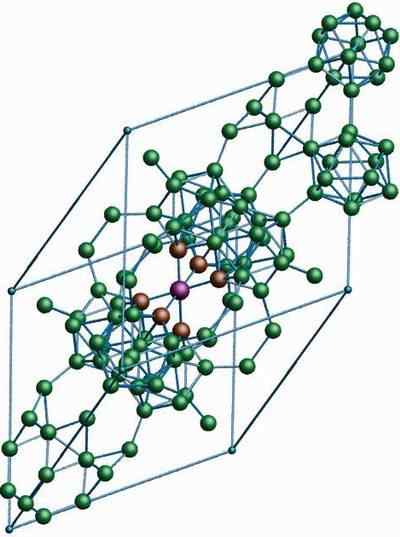 Β-romboédrico boorialotrooppisen β-romboédrico. Lähde: MaterialScientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Β-romboédrico boorialotrooppisen β-romboédrico. Lähde: MaterialScientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Β-romboédrico-boorialotrooppisella, kuten sen nimi jo osoittaa, on rhomboédica-kiteitä sekä boori-a; Se eroaa kuitenkin rakenteellisista yksiköistään. Näyttää siltä, että booriatomeilla tehdyn maan ulkopuolelta.
Se voi palvella sinua: litiumhydroksidi (LIOH)Jos näet huolellisesti Icosahedric -yksiköt hienovaraisella ja sulautuneella tavalla (keskellä). On myös B -yksiköitä10 ja yksinäiset booriatomit, jotka toimivat sillanna edellä mainittuihin yksiköihin. Kaiken kaikkiaan tämä on vakain boori -alotrope.
Boro-y Gema
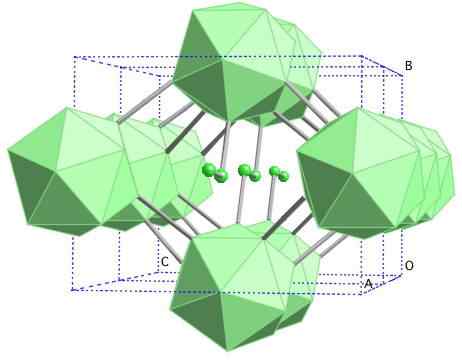 Boori-y: n kiteinen rakenne. Lähde: MaterialScientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Boori-y: n kiteinen rakenne. Lähde: MaterialScientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Tässä boorialotroopissa yksiköt B koordinoivat2 ja b12. B2 esittelee niin paljon elektronista puutetta, että itse asiassa poistavat elektronit B: stä12 Ja siksi tässä kiinteässä. Toisin sanoen ne eivät ole vain kovalenttisesti yhtenäisiä, vaan on tyyppinen sähköstaattinen vetovoima [b2-] [B12+-.
Boro-y kiteytyy GEMA-suolarakenteessa, sama kuin NaCl: lle. Muut boorista suuriin paineisiin (20 GPA) ja lämpötiloihin (1800 ° C) saadaan ja pysyvät sitten vakina normaaleissa olosuhteissa. Sen tosiasiallinen vakaus kilpailee β-Romboédrico-boorin kanssa.
Kuutio- ja amorfinen
Muut boorin alotrooppit koostuvat B -atomien aggregaateista ikään kuin metallisidos yhdistyisi, tai ikään kuin ne olisivat ionisia kiteitä; eli se on kuutio boori.
Myös ja vähiten, on amorfinen boori, jonka B -yksiköiden sijoitus12 Se on satunnainen ja sotkuinen. Se esitetään hienona tai lasimaisena tumman värin jauheena ja läpinäkymättömänä ruskeana.
Borofenos
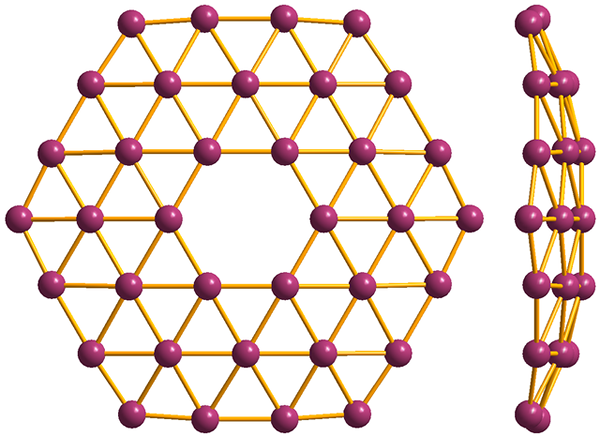 Borofenosin yksinkertaisimman rakenne, B36. Lähde: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Borofenosin yksinkertaisimman rakenne, B36. Lähde: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Ja lopuksi on boron: borofenos (korkeampi kuva) uusin ja omituisin alotrooppinen alotrooppinen. Se koostuu apinakerroksesta booriatomeja; erittäin ohut ja analoginen grafeenille. Huomaa, että se säilyttää kuuluisat kolmiot, jotka ovat ominaisia elektroniselle puutteelle, jota sen atomit kärsivät.
Borofenosten lisäksi, joista b36 Se on yksinkertaisin ja pieni, siellä on myös Boron klustereita. Borosfereeni (kuva alla) koostuu pallomaisesta häkistä, joka on samanlainen kuin Boron 40 atomin pallo, B40; Mutta sen sijaan, että ne ovat sileitä reunoja, ne ovat äkillisiä ja epäsäännöllisiä:
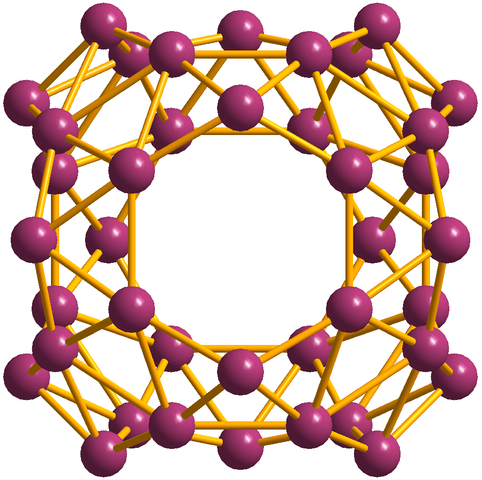 Borosferenos -yksikkö, B40. Lähde: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Borosferenos -yksikkö, B40. Lähde: MaterialScientist [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Elektroninen kokoonpano
Boorin sähköinen kokoonpano on:
[He] 2s2 2 p1
Siksi kolme elektronia Valenciasta. Hänestä puuttuu vielä viisi Valencian Octeton loppuun saattamiseksi, ja hän tuskin voi muodostaa kolme kovalenttisia sidoksia; Tarvitsen neljännen datiivisen linkin oktettin loppuun saattamiseksi. Boori voi menettää kolme elektroniaan saadakseen +3 hapettumistilan.
Saada
Boori eristetään vähentämällä boorihappoa magnesiumin tai alumiinin kanssa; Menetelmä, joka on samanlainen kuin Gay-Lussac ja Thénard. Sillä on vaikeuksia boorin pilaantumiseen näiden metallien boruroilla.
Korkea puhtaus näyte voidaan saada booritrikloridin tai tribromidin kaasumaisella pelkistämisellä vetyllä sähköisesti tantrisesti lämmitetyillä filamenteilla.
Korkea puhtaus boori valmistetaan hajottamalla korkeat diborano -lämpötilat, mitä seuraa puhdistaminen vyöhykkeen tai czocharalski -prosesseiden fuusiolla.
Sovellukset
Teollisuudessa
Alkuperäisen boorin on käytetty terästen kovettumisessa. Raudan seoksessa, joka sisältää välillä 0,001 - 0,005 % booria. Sitä käytetään myös ei -rautateollisuudessa, yleensä deoksidanttina.
Lisäksi booria käytetään mutaisena kuparipohjaisissa seoksissa ja korkeassa johtavuudessa kuparissa. Puolijohdeteollisuudessa pieniä määriä Boroa lisätään Piilin ja Germanion doping -aineena.
Voi palvella sinua: isopreno: rakenne, ominaisuudet, sovelluksetBoro -oksidi (B2JOMPIKUMPI3) sekoitetaan piidioksidin kanssa lämmönkestävän lasin (borosyylicatt Glass), jota käytetään keittiövälineissä ja tietyissä laboratoriolaitteissa.
Boro Carbide (B4C) Se on erittäin kova aine, jota käytetään hankaavana ja vahvistusaineena komposiittimateriaaleissa. Alumiini Boruro (Alb12) Sitä käytetään timanttipölyn korvikkeena himmeälle ja kiillotetulle.
Boroa käytetään seoksissa, esimerkiksi harvinaisten maametallien magneeteissa, seostaen raudan ja neodyymin kanssa. Muodostettuja magneetit käytetään mikrofonien, magneettikytkimien, kuulokkeiden ja hiukkaskiihdyttimien valmistuksessa.
Lääketieteellisesti
Boro-10-isotooppin kapasiteetti (10B) Aivokasvainten hoitoon on käytetty neutroneja α -tyyppisen säteilyn säteilemiseksi boorin neutronien sieppausterapian (BNCT) hoitoon (BNCT).
Hän 10B yhdisteiden muodossa kertyy syöpäkasvaimeen. Myöhemmin neutronien kasvainvyöhyke säteilee. Nämä ovat vuorovaikutuksessa 10B, mikä aiheuttaa a -hiukkasten päästöjä. Näillä hiukkasilla on korkea suhteellinen biologinen vaikutus, ja niiden suuren koon vuoksi heillä on vähän ulottuvuutta.
Joten a -hiukkasten tuhoisa vaikutus rajoittuu kasvainsoluihin, suorittaen niiden tuhoamisen. BNCT: tä käytetään myös kaulan, maksan, virtsarakon ja eturauhasen kasvainten käsittelyssä.
Biologinen vaikutus
Pieni määrä boorihappoa tai booria -muotoista booria on välttämätöntä monien kasvien kasvulle. Boorin puute ilmenee kasvien epämuodostuneesta kasvusta; vihannesten "ruskea sydän"; ja sokerijuurikkaan "kuiva mätää".
Boori voi olla tarpeen pieninä määrinä luun terveyden ylläpitämiseksi. On tutkimuksia, jotka osoittavat, että boorin puute osallistuisi niveltulehduksen luomiseen. Se puuttuisi myös aivotoimintoihin, kuten muisti ja koordinaatio silmä-mies.
Jotkut asiantuntijat huomauttavat, että 1,5-3 mg booria tulisi sisällyttää päivittäiseen ruokavalioon.
Riskit ja varovaisuus
Booria, boorioksidia, boorihappoa ja boratosia pidetään ei -toksisina. Eläinten LD50 on 6 g booria/kg kehon painoa, kun taas Aineita, joiden LD50 on yli 2 g/kg ruumiinpainoa.
Toisaalta yli 0,5 mg/booripäivän kulutus 50 päivän ajan aiheuttaa vähäisiä ruoansulatusongelmia, mikä viittaa toksisuuteen. Jotkut raportit huomauttavat, että boorin saannin ylimääräinen voi vaikuttaa vatsan, maksan, munuaisten ja aivojen toimintaan.
Samoin nenänielun, ylähengitysteiden ja silmien altistumisen boorille on osoitettu lyhytaikaisia ärsyttäviä vaikutuksia.
Raportit boorin toksisuudesta on niukasti ja monissa tapauksissa toksisuus esitetään erittäin suurina annoksina, korkeampi kuin väestö paljastetaan.
Suositus on seurata ruoan, erityisesti vihannesten ja hedelmien boorin pitoisuutta. Hallituksen terveysvirastojen on tarkkailtava, että vesiboorin pitoisuus ei ylitä sallittuja rajoja.
Booria sisältäville pölylle altistuneiden työntekijöiden tulisi käyttää naamioita, jotka suojaavat hengitysteiden, käsineitä ja erityisiä saappaita.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Boorin allotroopit. Haettu: vuonna.Wikipedia.org
- Prof. Robert J. Lancashire. (2014). Luento 5b. Elementtien rakenne (ei-metallit, B, C). Kemian laitos, Länsi -Intian yliopisto, Mona Campus, Kingston 7, Jamaika. Palautettu: Chem.Uwimona.Edu.JM
- Manisha Lalloo. (28. tammikuuta 2009). Löydetty ultra-turha boorirakenne. Kemiamaailma. Toipunut: ChemistryWorld.com
- Bell Terence. (16. joulukuuta 2018). Metalliboorin profiili. Toipunut: Tasapaino.com
- Enyclopaedia Britannica -toimittajat. (2019). BOORI. Toipunut: Britannica.com
- Myrkyllisten aineiden ja sairausrekisterin virasto. (2010). Toxfaqs ™ boorissa. [PDF]. Haettu: Atsdr.CDC.Hallitus
- Helmestine, Anne Marie, PH.D -d. (6. helmikuuta 2019). Boorikemialliset ja fysikaaliset ominaisuudet. Toipunut: Admingco.com

