Bromin historia, rakenne, elektroninen kokoonpano, ominaisuudet, käyttää

- 2139
- 202
- Alonzo Kirlin
Hän bromi Se on ei -metallinen elementti, joka kuuluu jaksollisen taulukon halogeeniryhmään, ryhmään 17 (VIIA). Sen kemiallinen symboli on BR. Se esitetään diatomisena molekyylinä, jonka atomit yhdistyvät kovalenttisella sidoksella, joten molekyyl kaava on määritetty2.
Toisin kuin fluori ja kloori, bromi maanpäällisissä olosuhteissa ei ole kaasua, vaan punertava ruskea neste (alempi kuva). Se on tupakointi, ja se on yhdessä elohopean, ainoiden nestemäisten elementtien kanssa. Sen alapuolella jodi, vaikka sen väri vahvistuu ja muuttuu violetiksi, voi kiteyttää haihtuvan kiinteän aineen.
 Pullo puhtaalla nestemäisellä bromilla. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]
Pullo puhtaalla nestemäisellä bromilla. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Bromon löysi itsenäisesti vuonna 1825 Carl Löwig, joka opiskeli saksalaisen kemisti Leopold Gmelinin johdolla; Ja vuonna 1826 ranskalainen kemisti Antoine-Jerome Ballard. Balardin kokeellisten tulosten julkaisu kuitenkin edelsi Löwigin tuloksia.
Bromo on 62. runsain elementti maan päällä, jakautuu matalissa pitoisuuksissa maan aivokuorella. Meressä keskimääräinen pitoisuus on 65 ppm. Ihmiskeho sisältää 0,0004 % bromia, joka ei tiedä lopullisesti sen toimintaa.
Tätä elementtiä hyödynnetään kaupallisesti Salmuelasissa tai paikoissa, joissa erityisissä olosuhteissa on korkeat suolat; Esimerkiksi Kuolleenmeren, johon naapurialueiden vedet, kyllästetty suoloilla, lähentyvät.
Se on syövyttävä elementti, joka kykenee hyökkäämään metalleihin, kuten platina ja paladiumi. Vesiin liuenneen bromin voi myös aiheuttaa sen syövyttäviä vaikutuksia ihmisen kudoksiin, tilanteen raskauttamiseen, koska bromhytihapo voidaan tuottaa. Myrkyllisyyden suhteen se voi aiheuttaa tärkeitä vaurioita elimille, kuten maksa, munuaiset, keuhkot ja vatsa.
Bromi on erittäin haitallinen ilmakehässä, ja se on 40–100 kertaa tuhoisampi otsonikerrokselle kuin kloori. Puolet otsonikerroksen menetyksestä Antarktikassa syntyy bromometyyliin liittyvien reaktioiden, fumigantina käytetty yhdiste.
Sillä on lukuisia käyttötarkoituksia, kuten: palonopeus, valkaisuaine, pinta -desinfiointiaine, polttoainelisäaine, välittäjä sedatiivisessa valmistuksessa, orgaanisten kemikaalien valmistuksessa jne.
[TOC]
Historia
Carl Löwig -työ
Bromo löysi saksalaisen kemisti Carl Jacob Löwigin itsenäisesti ja melkein samanaikaisesti ja Antoine Barard, ranskalainen kemisti Antoine Barard, vuonna 1826.
Saksalaisen kemisti Leopold Gmelinin opetuslapsi Carl Löwig keräsi vettä huonolta Kreuznachin keväästä ja lisäsi klooria; Eetterin lisäämisen jälkeen hän sekoitti nesteiden seosta.
Sitten eetteri erotettiin tislaamalla ja konsentroi sen haihtumalla. Seurauksena hän sai punertavan ruskean aineen, joka oli bromi.
Antoine Balaard -työ
Balard puolestaan käytti ruskean levyn tuhkaa. Siten bromo vapautui, kloori kulki uuttoa altistuneen vesimateriaalin läpi, jossa magnesiumbromidi, MGBR oli läsnä2.
Myöhemmin materiaali tislattiin mangaanidioksidin ja rikkihapon läsnä ollessa tuottaen punaista höyryä, jotka tiivistyivät tummaksi nesteeksi. Balardin mielestä se oli uusi elementti ja kutsui häntä Muride, johdettu latinalaisesta sanasta Muria, jonka kanssa suolavesi oli nimetty.
Se voi palvella sinua: Elävä aine: Konsepti, ominaisuudet ja esimerkitOn huomautettu, että Balard muutti Muride-nimen Brômeksi Angladan tai Gay-Lussacin ehdotuksella, joka perustuu siihen, että Brôme tarkoittaa turhaa, joka määrittelee löydetyn elementin hajun.
Tulokset julkaisivat Belard Annales of Chemie and Fysique, ennen kuin Löwig julkaisi omansa.
Vain vuodesta 1858 bromia tuotettiin tärkeinä määrinä; Vuosi, jolloin Stassfurt -suolakerrostumat löydettiin ja hyväksikäytettiin, saaden bromia.
Elektroninen bromirakenne ja kokoonpano
Molekyyli
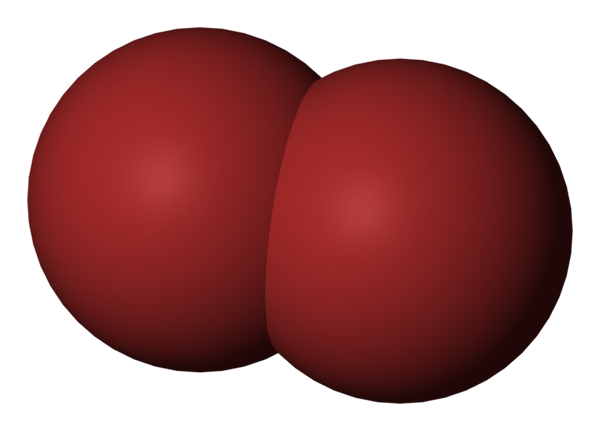 BR2 -molekyyli. Lähde: Benjah-BMM27 [julkinen alue].
BR2 -molekyyli. Lähde: Benjah-BMM27 [julkinen alue]. Yläkuvassa bromimolekyyli on esitetty, BR2, Kompakti täyttömalli. Itse asiassa kahden bromiatomin välillä on yksinkertainen kovalenttinen sidos, br-br.
Koska se on diatominen ja homogeeninen molekyyli, sillä ei ole pysyvää dipolimomenttia ja se voi olla vuorovaikutuksessa vain muiden samantyyppisten kanssa Lontoon dispersiovoimien kautta.
Tästä syystä punertava neste tupakoi; BR -molekyyleissä2, Vaikka heidän molekyylien väliset voimansa ovat suhteellisen raskaita, ne pitävät heidät heikosti sidoksissa.
Bromo on vähemmän elektronegatiivinen kuin kloori, ja siksi sillä on pienempi vetovoimavaikutus Valencia -kerroksen elektroneihin. Seurauksena on, että se vaatii vähemmän energiaa korkeamman energiatason matkustamiseksi, vihreiden fotonien absorboimiseksi ja punertavan värin heijastamiseksi.
Kiteet
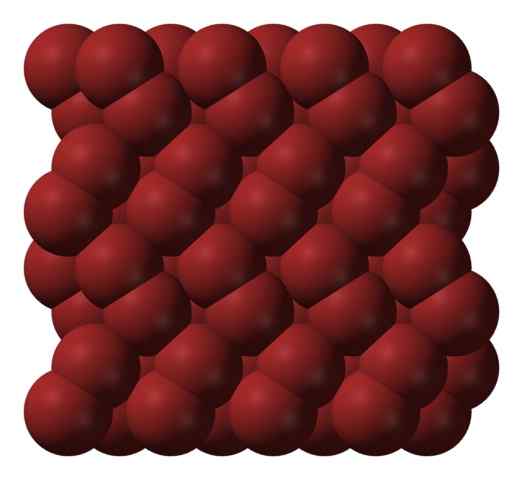 Bromikiteinen rakenne. Lähde: Ben Mills [julkinen alue].
Bromikiteinen rakenne. Lähde: Ben Mills [julkinen alue]. BR -molekyylit2 Ne erottuvat huomattavasti, kunnes niiden välillä on tehokasta vuorovaikutusta. Sulamispisteen alapuolella bromi voidaan kuitenkin jäädyttää punertavan ortoromin kiteissä (ylivoimainen kuva).
Huomaa, kuinka BR -molekyylit2 Ne on sijoitettu järjestäytyneinä siten, että ne näyttävät "bromimatoista". Täällä ja näissä lämpötiloissa (t < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Valencia -kerros ja hapettumistilat
Elektroninen bromikokoonpano on:
[AR] 3D104S2 4P5
3D104S2 4P5 sen valenssikerros (vaikka 3D -kiertoradalla10 Ei ole näkyvyyttä kemiallisissa reaktioissasi). 4S- ja 4p -orbitaalien elektronit ovat uloimpia ja lisäävät yhteensä 7, vain yksi elektroni Valencian oktetin loppuun saattamiseksi.
Tästä kokoonpanosta mahdolliset hapettumistilat voidaan päätellä bromille: -1, jos elektroni saa erolektronisen Kriptoniin; +1, oleminen kuin 3D104S2 4P4; +3, +4 ja +5, menettäen kaikki 4P -kiertoradan ([AR] 3D: n elektronit104S24P0 -) ja +7, juokseminen ilman elektroneja 4S -kiertoradalla ([AR] 3D104S0 -4P0 --A.
Ominaisuudet
Fyysinen ulkonäkö
Pieni tummanruskea punertava neste. Sitä löytyy luonnosta diatomisena molekyylinä, atomit yhdistyvät kovalenttisella sidoksella. Bromo on tiheämpi neste kuin vesi ja uppoaa siihen.
Voi palvella sinua: Radio: Rakenne, ominaisuudet, käyttötarkoitukset, hankkiminenAtomipaino
79 904 g/mol.
Atominumero
35.
Haju
Hehtaarin savu, tukahduttava ja ärsyttävä.
Sulamispiste
-7,2 ºC.
Kiehumispiste
58,8 ºC.
Tiheys (BR2) neste
3 1028 g/cm3
Vesiliukoisuus
33,6 g/l a 25 ° C. Bromin liukoisuus veteen on alhainen ja pyrkii nousemaan vähentämällä lämpötilaa; käyttäytyminen samanlainen kuin muut kaasut.
Liukoisuus
Liukenee vapaasti alkoholiin, eetteriin, kloroformiin, hiilitetrakloridiin, hiilidisulfidiin ja konsentroituun suolahappoon. Liukenevat ei -polaarisiin liuottimiin ja jonkin verran polaarisia, kuten alkoholia, rikkihappoa ja monissa halogenoiduissa liuottimissa.
Kolminkertainen
265,9 K 5,8 kPa.
Kriittinen piste
588 K 10,34 MPa.
Fuusiolämpö (BR2-A
10 571 kJ/mol.
Höyrystymislämpö (BR2-A
29,96 kJ/mol.
Molaarinen kalorikapasiteetti (BR2-A
75,69 kJ/mol.
Höyrynpaine
Lämpötilassa 270 K, 10 kPa.
Itsekiinnityslämpötila
Ei syttyvä.
sytytyspiste
113 ºC.
Säilytyslämpötila
2 - 8 ºC.
Pintajännitys
40,9 mn/m 25 ºC.
Hajukynnys
0,05 - 3,5 ppm. 0,39 mg/m3
Taiteindeksi (ηD)
1 6083 - 20 ºC ja 1 6478 - 25 ºC.
Elektronegatiivisuus
2.96 Pauling -asteikolla.
Ionisaatioenergia
- Ensimmäinen taso: 1.139,9 kJ/mol.
- Toinen taso: 2.103 kJ/mol.
- Kolmas taso: 3.470 kJ/mol.
Atomiradio
120 pm.
Radiokovalenttinen
120.3 PM.
Van der Waals -radio
185.
Reaktiivisuus
Se on vähemmän reaktiivinen kuin kloori, mutta reaktiivisempi kuin jodi. Se on hapettia, joka on vähemmän vahva kuin kloori ja vahvempi kuin jodi. Se on myös heikompi pelkistävä aine kuin jodi, mutta vahvempi kuin kloori.
Kloorihöyry on erittäin syövyttävää monille materiaaleille ja ihmisen kudoksille. Se hyökkää monia metallielementtejä, mukaan lukien platina ja paladiumi; Mutta se ei hyökkää lyijyä, nikkeliä, magnesiumia, rautaa, sinkkiä ja alle 300 ºC joko natriumiin.
Bromo vedessä kokee muutoksen ja muuttuu bromidiksi. Se voi olla myös bromaattina (veli3-), Nesteen pH: sta riippuen.
Hapettavan vaikutuksensa vuoksi bromi voi indusoida happivapaiden radikaalien vapautumisen. Nämä ovat vahvoja hapettimia ja voivat aiheuttaa kudosvaurioita. Bromi voi myös tuottaa spontaanin sytytyksen yhdistettynä kaliumin, fosforin tai tinan kanssa.
Sovellukset
Bensiinilisäaine
Etyleenidibromidia käytettiin mahdollisten lyijykerrostumien poistamiseen autojen moottoreissa. Bensiinin palamisen jälkeen, joka käytti lyijyä lisäaineena, bromia yhdistettynä lyijyn muodostamiseen lyijybromidiin, haihtuva kaasu, joka karkotettiin pakoputkella.
Vaikka bromi eliminoi johdon bensiinistä, sen tuhoava toiminta otsonikerroksessa oli erittäin voimakas, minkä vuoksi se hylättiin tälle sovellukselle.
Torjunta -aineet
Metyleeniä tai bromimetyylibromidia käytettiin torjunta -aineena maaperän puhdistamiseen, etenkin loisten nematodien, kuten mikä tahansa.
Useimpien bromien sisältävien yhdisteiden käyttö on kuitenkin hylätty taas tuhoava otsonikerroksessa.
Elohopean liikkeeseenlaskuvalvonta
Bromoa käytetään joissakin kasveissa elohopeapäästöjen vähentämiseksi, erittäin myrkyllinen metalli.
Voi palvella sinua: gravimetria: gravimetrinen analyysi, menetelmät, käytöt ja esimerkitValokuvaus
Hopeabromidia, hopea -Yoduron ja hopeakloridin lisäksi, käytetään kevyenä herkänä yhdisteenä valokuvausemulsioissa.
Terapeuttiset toimet
Kaliumbromidia, samoin kuin litiumbromidia, käytettiin 1800 -luvun yleisinä rauhoittavina ja 2000 -luvun alkupuolella. Yksinkertaisia suoloja käytetään edelleen joissakin maissa, kuten antikonvulsioissa.
Yhdysvallat FDA ei kuitenkaan hyväksy bromin käyttöä minkä tahansa taudin hoidossa.
Tulipalon hidastin
Bromia transformoi liekit bromhorihappoksi, joka häiritsee tulen aikana tapahtuvaa hapettumisreaktiota ja tuottaa sen sukupuuttoon. Polymeerejä sisältyy bromiin.
Elintarvikelisäaine
Kaliumbromaattijäljet jauhoihin on lisätty sen ruoanlaiton parantamiseksi.
Kemialliset reagenssit ja välittäjä
Vetybromidia käytetään pelkistävänä aineena ja katalysaattorina orgaanisille reaktioille. Bromoa käytetään kemiallisena välittäjänä lääkkeiden, hydraulisten nesteiden, kylmäaineiden, ilmankuivaimien valmistuksessa ja valmistuksissa hiusten aaltoimiseksi.
Se löytää myös kaivon porausnesteiden, veden desinfiointituotteiden, valkeahkojen aineiden, pinta -desinfiointiaineen, väriaineiden, polttoainelisäaineiden jne. Kehittämisessä.
Biologinen vaikutus
Vuonna 2014 suoritettu tutkimus osoittaa, että bromi on välttämätön kofaktori kollageeni IV biosynteesille, mikä tekee bromista olennaisen elementin eläinkudoksen kehitykselle. Elementin alijäämän seurauksista ei kuitenkaan ole tietoa.
Missä se sijaitsee
Bromo uutetaan kaupallisesti suolakaivoksista ja syvistä Salmuelas -kaivoista, joita löytyy Arkansasin osavaltiosta ja Utahin suuresta suolaisesta järvestä, molemmat Yhdysvalloissa. Tällä viimeisellä suolavedellä on 0,5 % bromipitoisuus.
Bromin poimimiseksi.
Kuollut meri Jordanian ja Israelin välisellä rajalla on suljettu meri, joka on merenpinnan alla, mikä tekee siitä erittäin korkean suolakonsentraation.
Bromo ja poassa saadaan kaupallisesti siellä haihduttamalla vettä, jolla on korkea suola kuolleen meren suola. Tässä meressä bromipitoisuus voi saavuttaa 5 g/l.
Sitä löytyy myös korkeista pitoisuuksista joissakin kuumissa lähteissä. Esimerkiksi Bominita on hopeabromidi mineraali, joka löytyy Boliviasta ja Meksikosta.
Riskejä
Nestemäisessä tilassa oleva bromi on syövyttävä ihmisen kudoksille. Mutta suurin vaara ihmiselle tulee bromihöyryistä ja hengitystä.
Hengitä ympäristössä, jonka bromipitoisuus on 11-23 mg/m3 Se tuottaa vakavia iskuja. Pitoisuus 30-60 mg/m3 Se on erittäin haitallista. Samaan aikaan 200 mg: n pitoisuus voi olla tappava.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Kansallinen bioteknologiatietojen keskus. (2019). Bromi. Pubchem -tietokanta. CID = 23968. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Ross Rachel. (8. helmikuuta 2017). Faktoja bromista. Toipunut: LivesCience.com
- Wikipedia. (2019). Booraksi. Haettu: vuonna.Wikipedia.org
- Lentech b. V. (2019). Bromi. Toipunut: lentech.com
- « Myosiinin ominaisuudet, rakenne, tyypit ja toiminto
- Nuklea -ominaisuudet, rakenne, tyypit ja toiminnot »

