Myosiinin ominaisuudet, rakenne, tyypit ja toiminto
- 4189
- 1041
- Dr. Travis Reichert
Se Myosiini Se on molekyylimoottori, proteiinin luonne, joka kykenee siirtymään aktiinifilamenteihin sytosolissa. Myosiinin siirtymistä ohjaava energia tulee ATP -hydrolyysistä. Tämän vuoksi myosiini määritellään yleensä mekanokemian entsyymiksi.
Eukaryooteissa myosiini on erittäin runsas proteiini. Myosiinia on erilaisia, jotka koodaavat geeniryhmä. Hiivoissa 5 luokkaa erotetaan, kun taas kymmeniä on kuvattu nisäkkäissä.
 Lähde: David Richfield (käyttäjä: Slashme) Kun käytät tätä kuvaa ulkoisissa teoksissa, se voidaan mainita seuraavasti: Richfield, David (2014). "David Richfieldin lääketieteellinen galleria". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]
Lähde: David Richfield (käyttäjä: Slashme) Kun käytät tätä kuvaa ulkoisissa teoksissa, se voidaan mainita seuraavasti: Richfield, David (2014). "David Richfieldin lääketieteellinen galleria". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002-4436. [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]] Myosiinilla on laaja valikoima toimintoja. Myosiini I, Actinin vieressä, osallistuu keratosyyttien liikkeeseen.
Myosiini II tarjoaa jäykkyyden plasmamembraanille, osallistuu sytokiiniin ja lihasten supistumiseen. Molemmat, myosinas I ja II, tekevät yhteistyötä solujen migraation kanssa. Myosinas I ja V suorittavat vesikkelien kuljetuksen aktiinifilamentteja pitkin.
[TOC]
Rakenne
Elektronisissa mikrokuvissa tyypillisessä myosiini -isomuotorakenteessa on kolme domeenia: pää, kaula ja häntä. Hydrolyysin avulla kimotripsiinillä, segmentti, joka koostuu päästä ja kaulasta, jota kutsutaan raskaaksi meromosiiniksi (HMM) ja saadaan pyrstösegmentiksi, jota kutsutaan kevyeksi meromosiiniksi (LMM).
Pään hallitseminen on raskaan ketjun N-terminaalinen pää, ja hännän domeeni on kevyen ketjun C-terminaalinen pää.
Myosiiniluokat voidaan erottaa sen säveltävien polypeptisten ketjujen lukumäärällä sekä runsaasti ja kevyessä ketjussa.
Myosiini Minulla on polypeptidiketju, joka muodostaa pään ja sen hänestä puuttuu alfa -helikidialueita. Kun taas myosinasilla minulla ja V: llä on kaksi polypeptidiketjua, ja siellä.
Myosinas I: llä ja V: llä on ammattipaikat kalmoduliiniin, joka säätelee ja korjaa CA+2, Kevyissä ketjuissa. Myosina, jonka korjasin CA: n+2 Kevyissä ketjuissa, mutta se toimii niin eri tavalla kuin kalmoduliini.
Ominaisuudet
Mekaanisella tasolla myosinoilla on kolme ominaisuutta, nimittäin:
- Myosiinin pää on motorinen alue, joka etenee huomaamattomien vaiheiden avulla: myosiinin liiton aktiinifilamentti, sen kallistus ja sitä seuraava erottelu tuottavat myosiinin liikkumisen. Tämä prosessi on syklinen ja riippuu ATP: stä.
- Konformaatiomuutokset: ATP -molekyylin hydrolyysi on kytketty myosiinimolekyylin jokaiseen vaiheeseen monistus- ja siirtotasojen avulla. Tämä tarkoittaa myosiinin suuria konformaatiomuutoksia.
Voi palvella sinua: Radiaalinen symmetriaEnsimmäinen monistusaste tuotetaan ATP: n gamma-fosfaattiryhmän menetyksellä, mikä mahdollistaa rakenneosien uudelleenorganisoinnin ATP-unionin alueella. Tämä uudelleenorganisointi on koordinoitu rakenteellisten muutosten kanssa unionin alueella aktiiniin.
Toinen monistusaste merkitsee konformaatiomuutoksen viestintää aktiivisessa kohdassa terminaalikarboksyylin rakennekomponentteja.
- Suuntaus: On havaittu, että kaivoksellani on polaarisuus tai käänteinen suuntaus aktiinifilamentin päätä (+). Tämä johtopäätös tulee aktiinifilamentin tasoituskokeista käyttämällä fluoresenssin optista mikroskooppia.
Funktiot
Aktiinin vieressä oleva myosiini osallistuu lihasten supistumiseen, solujen tarttumiseen, sytokiiniin, lahjoittavuuden myöntämiseen aivokuoren kalvoille ja joidenkin vesikkelien siirtymiseen, muun muassa muun muassa.
Myosiinivirheet voivat tuottaa patologisia olosuhteita. Esimerkiksi Myosinas I: n ja V: n viat liittyvät vastaavasti myosiini- ja pigmentaatiohäiriöiden myosiini- ja pigmentaatiohäiriöihin (Grisellin oireyhtymä). Vaikka myosiinisformien häiriöt VI aiheuttavat korvan menetyksen.
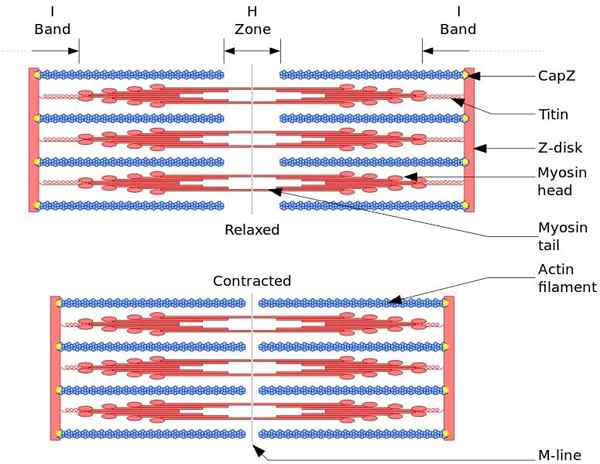
Lihassupistus
Luustolihasten toiminnallinen ja rakenneyksikkö on sarkomro. Lihasten supistumisen aikana sarkomeerin pituus saavuttaa 30% alkuperäisestä pituudestaan.
Sarkomeerit koostuvat paksusta, myosiinista ja ohuista aktiinifilamenteista, jotka on järjestetty monimutkaisella tavalla. Yleensä myosiinin päät sijaitsevat filamentin distaalisissa päissä ja sen hännät kohti sarkomeron keskustaa, ja organisaatio on kaksisuuntainen.
Lihasten supistumisen tekemiseksi, vastakkaisista päistä myosiinin päät, on siirryttävä filamentin Z -levylle tai päähän (+). Koska paksujen filamenttien organisointi on kaksisuuntaista, paksujen filamenttien ohuiden filamenttien liukuminen tapahtuu ATP: n ohjaamana.
Siirtymävoima tapahtuu, koska sadat myosiinin päät, paksu filamentti, ovat vuorovaikutuksessa ohuen filamentin kanssa.
Sytosiinit
Mitoosin aikana, kun karan pylväiden mikrotubulukset erotetaan, aktiini ja myosiini II muodostavat supistuvan renkaan solun solussa. Tämä rengas supistaa halkaisijan ja jakaa solun kahteen osaan.
Aivokuoren kalvojen jäykkyyden myöntäminen
Mutanttisoluissa, joista puuttuu myosiini II, plasmamembraani on helposti muodonmuutos, kun ulkoinen voima kohdistetaan. Tämä tapahtuu, koska myosiini II tarjoaa aggregaatiovoiman plasmamembraaniproteiineille.
Voi palvella sinua: morfologinen sopeutuminenSolujen tarttuvuus
Epiteelikudoksessa supistuvat aktiini- ja myosiini II -säteet sijaitsevat plasmamembraanin lähiöissä ja muodostavat pyöreän hihnan, joka ympäröi solujen solun pintaa. Tämä pyöreä vyö määrittää solun muodon ja ylläpitää solujen välistä liitoa.
Solujen välinen kosketus tapahtuu ympyrävyön liitoksella solujen tarttumisen molekyyleihin käyttämällä sitoutuvia proteiineja.
Joidenkin rakkuloiden siirtyminen
Kokeellinen näyttö paljastaa, että myosiini V suorittaa kalvon kuljetuksen Golgi -laitteesta solun reunaan. Jotkut todisteet ovat:
- Hermostosoluissa astrosyyttien immunofluoresenssilla havaittiin, että myosiini V sijaitsee Golgin vieressä.
- Hiivoissa mutaatiot myosiini V -geenissä keskeyttää proteiinien erityksen ja siten proteiinit kerääntyvät sytosoliin.
- Myosiini I -isoformit vastaavat tyhjöiden kuljettamisesta solukalvoon. Käyttämällä spesifisiä vasta -aineita myosiini I -isoformeja vastaan, havaittiin, että nämä isoformit sijaitsevat solun eri osissa.
Esimerkiksi, kun elävä amoeba on merkitty vasta -aineella myosiinia vastaan, tyhjön kuljetus kalvoon pidätetään. Tämän vuoksi tyhjö laajenee ja solu räjähtää.
Myosiiniin liittyvät sairaudet
Myosinas ja korvan menetys
On olemassa lukuisia geenejä ja mutaatioita, jotka aiheuttavat korvan menetyksen. Tämä tauti on usein monogeneettinen .
Mutaatiot epätavanomaisissa myosinoissa, joissa on yksi tai kaksi myosiinin päätä, vaikuttavat sisäisen korvan toimintaan. Jotkut mutatoituneista myosiini -isomeista ovat myosiini IIIA, myosiini VIIA ja myosiini XVA. Äskettäin myosiini VI: stä löydettiin kaksi mutaatiota.
Myosiini VI: n mutaatiot ovat c.897g> t ja p.926Q. Ensimmäinen mutaatio vaikuttaa alueeseen, joka on vuorovaikutuksessa aktiivisen sijaitsevan, nimeltään Switch I: n kanssa. Homotsygoottinen mutaatiolle varhaisessa vaiheessa on fenotyyppi, aiheuttaen vakavia vaikutuksia.
Toinen mutaatio vaikuttaa kuormitusalueen alueelle alfa -potkurissa myosiinin VI: n hännässä. Tämä alue on tärkeä moottorin proksimaalisen dimeroinnin kannalta ja vaikuttaa myosiinin stereo-kaavion toimintaan.
Se voi palvella sinua: biologian aputieteetToinen mutaatio on P.ASN207SER, joka tuottaa moottorin, joka ei pysty tuottamaan lujuutta. Tämä johtuu siitä, että ASN 207 on aktiivisen kohdan aminohappotähde, jonka toiminta on ATP: n liitto ja hydrolyysi.
Mutaatio p.Arg657TRP tuottaa myosiini VI -funktion menetyksen. Arg -jäännös on mukana konformaatiomuutoksissa, jotka kiinnittävät hydrolyysin myosiinin liikkeeseen.
Myosiini X ja syöpä
Myosina X (Myo10) on epätavallinen myosiini, joka ilmaistaan aivoissa, endoteelissa ja monissa epiteeleissä. Myo10 ja kolmen tyyppiset aktiinipohjaiset projektiot (filopodialaiset filopodit, laskujät ja ennusteet) työskentelevät syöpämetastaasien aikana.
Invasiivisilla syöpäsoluilla on suuri määrä filopodeja ja ne ilmentävät korkeat fassiinitasot. Tämä proteiini suorittaa leikkaukset aktiinifilamenttien välillä. Primaarikasvaimesta paetakseen muodostetaan hyökkäyksiä, runsaasti proteolyyttistä aktiivisuutta, joka sulattaa ympäröivän solunulkoisen matriisin.
Kun solut saavuttavat solunulkoisen matriisin, Philopodes -kaltaiset projektiot auttavat leviämään ja siirtämään. Korkeat Myo10 -tasot osoittavat korkean aggressiivisuuden ja etäpesäkkeet rintasyövässä.
Myoxin vaimennus tuottaa solujen metastaattisen luonteen menetyksen, jotka eivät pysty muodostamaan aktiinipohjaisia projektioita. Kaikissa näissä projektioissa on ymmärrettäviä adheesioita, jotka My1010 kuljettaa filopodiumissa.
MYOX on mukana keskuksien muodostumisessa. Myoxin puuttuminen suosii multippulaaristen piikkien muodostumista. MYOX on mukana myös syöpäsolujen signaloinnissa. Esimerkiksi MYOX aktivoituu 3,4,5, -inositol-trifosfaatilla (PIP3).
Viitteet
- Alberts, b., Johnson, a., Lewis, J., ja kaali. 2007. Solumolekyylin biologia. Garland Science, New York.
- Brownstein, Z., Abu-rayyan, a., Karfunkel-Don, D., Sirigu, S., Davido, b., Shohat, m., Frydman, M., Houdusse, a., Kanaan, m., Avraham, k. 2014. Uudet myosiinimutaatiot perinnölliselle kuulonmenetykselle, jotka on paljastettu kohdennetulla genomisella sieppauksella ja massiivisesti yhdensuuntaisella sekvensointi. European Journal of Human Genetics, 22: 768 -775.
- Courson, D.S. ja cheney, r.JA. 2015. Myosiini-X ja sairaus. Kokeellinen solututkimus, 334: 10-15.
- Loodish, h., Berk, a., Zipurski, S.Lens., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Solu- ja molekyylibiologia. Toimitus Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Meksiko, Sāo Paulo.
- Schliwa, m. ja Woehlke, G. 2003. Molekyylimoottorit. Nature, 422: 759 - 765.
- Arvoinen.D -d. 2003. IntAcellulaarisen kuljetuksen molekyylityökalupakki. Cell, 112: 467-480.
- « Eksonukleaasiominaisuudet, rakenne ja toiminnot
- Bromin historia, rakenne, elektroninen kokoonpano, ominaisuudet, käyttää »

