Butanaalinen rakenne, ominaisuudet, käytöt ja riskit
- 4957
- 814
- Ronald Reilly
Hän Bunaali Se on avoimen ketjun aldehydi, joka koostuu neljästä hiiliatomista ja on analoginen butaanille; Se on itse asiassa butaanihiiliveden toiseksi hapettunein muoto butyrihappojen jälkeen. Sen molekyyl kaava on CHO3CH2CH2Cho, missä -Cho on Formil -ryhmä.
Tämä aldehydi, yksi kevyimmistä, koostuu läpinäkyvästä, syttyvästä ja vähemmän tiheästä nesteestä kuin vesi. Lisäksi se liukenee veteen ja sekoittuu useimpien orgaanisten liuottimien kanssa; Siksi sitä voidaan käyttää yhden vaiheen orgaanisten seoksien saamiseen.
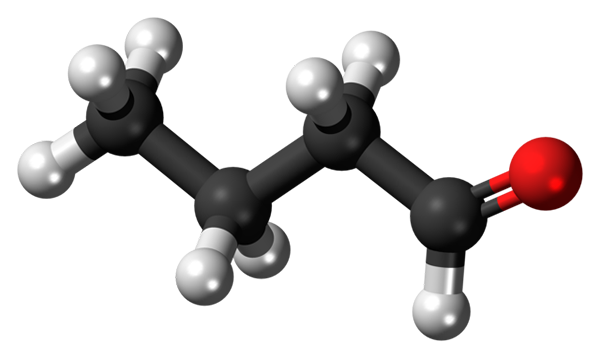
 Butanal tai butiraldehydi -molekyyli. Lähde: Jynto [CC0]
Butanal tai butiraldehydi -molekyyli. Lähde: Jynto [CC0] Karbonyyliryhmän (punaisen pallon, ylivoimaisen kuvan) läsnäolo antaa kemiallisen polaarisuuden butanaalimolekyylille ja siten kyvyn kokea dipoli-dipolo-vuorovaikutus sen molekyylien välillä; Vaikka niiden välillä ei muodostua vety silloja.
Tämä johtuu seurauksena siitä, että butanaalissa esiintyvä kiehumis- ja fuusiopisteet ovat suurempia kuin butaani, mutta vähemmän kuin n-boutyylialkoholin esittämät.
Butanalia käytetään liuottimena ja on välittäjä lukuisten tuotteiden saamiseksi; kuten kaasupolkukoneet, jotka koskevat kuppien, hartsien, farmaseuttisten ja maatalouden tuotteiden vulkanisointia.
Butanaali on myrkyllinen yhdiste, joka hengittää ylähengitysteiden, keuhkojen ja keuhkojen turvotuksen tulehdusta, jolla voi olla jopa kohtalokkaita seurauksia.
[TOC]
Butanaalirakenne
Juuri on mainittu, että formil -ryhmä, -CH. Tämän seurauksena heidän molekyylit voivat olla vuorovaikutuksessa toistensa kanssa dipoli-dipolovoimien kautta.
Voi palvella sinua: kiertokuivaus: toiminta, mihin se on, osat, sovelluksetYläkuvassa se on esitetty, pallo- ja tankojen mallilla, että butanaalimolekyylillä on lineaarinen rakenne. Ryhmän hiili -cholla on SP -hybridisaatio2, kun taas jäljellä olevat hiilit3.
Paitsi, että se on myös joustava, ja niiden linkit voivat pyöriä omilla akseleillaan; Ja siten syntyy erilaisia konformaatioita tai konformereja (sama yhdiste, mutta niiden pyöritetyillä linkillä).
Konformerot
Seuraava kuva selittää parhaiten tämän kohdan:
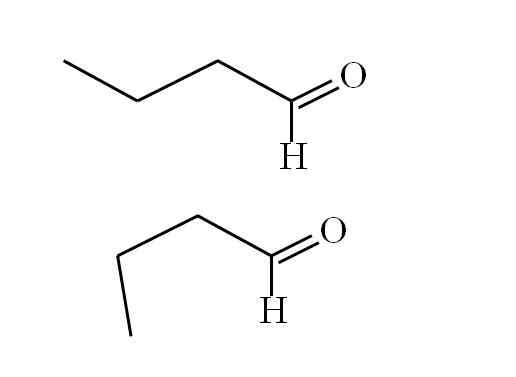 Butanal mukautuu. Lähde: Gabriel Bolívar.
Butanal mukautuu. Lähde: Gabriel Bolívar. Ensimmäinen konformeri (ylivoimainen) vastaa ensimmäisen kuvan molekyyliä: vasemmalla oleva metyyliryhmä, -CH3, ja ryhmä -CHO, on vastakkaisissa asennoissa; yksi osoittaa ja toinen alaspäin.
Samaan aikaan toinen konformeri (alempi) vastaa molekyyliä -CH: n kanssa3 ja -HO pimennettyissä asennoissa; eli molemmat kohta samaan suuntaan.
Molemmat konformeerit ovat nopeasti vaihdettavissa, ja siksi butanaalimolekyyli pyörii ja värisee jatkuvasti; Ja lisäsi sen, että hänellä on pysyvä dipoli, tämä antaa hänen vuorovaikutuksensa olla riittävän vahvat kiehua 74,8ºC: ssa.
Ominaisuudet
Kemialliset nimet
-Bunaali
-Butiraldehydi
-1-butanali
-Butiraalinen
-N-butiraldehydi.
Molekyylikaava
C4H8Tai ch3CH2CH2Köyhä.
Fyysinen ulkonäkö
Se on kirkas, läpinäkyvä neste.
Haju
Tyypillinen haju, acre, aldehydi.
Kiehumispiste
167 ºF 760 mmHg (74,8 ºC).
Sulamispiste
-146 ºF (-96,86 ºC).
sytytyspiste
-8 ºF (-22 ºC) suljettu lasi.
Vesiliukoisuus
7 g/100 ml 25 ° C: ssa.
Liukoisuus orgaanisiin liuottimiin
Sekoittuu etanolin, eetterin, etyyliasetaatin, asetonin, tolueenin ja monien muiden orgaanisten liuottimien kanssa.
Tiheys
0,803 g/cm3 68 ºF.
Voi palvella sinua: Nitraatit: Ominaisuudet, rakenne, nimikkeistö, koulutusHöyryn tiheys
2,5 (ilmasuhteessa, joka on yhtä suuri kuin 1).
Höyrynpaine
111 mmHg 25 ºC: n lämpötilassa.
Itsenäinen
446 ºF. 425 ºF (21,8 ºC).
Goo
0,45 CPOISE 20 ºC: n lämpötilassa.
Palamislämpö
2479,34 kJ/mol 25 ° C: ssa.
Höyrystyslämpö
33,68 kJ/mol 25 ° C: ssa.
Pintajännitys
29,9 Dina/cm A 24 ºC.
Hajukynnys
0,009 ppm.
Taitekerroin
1 3843 - 20 ºC.
Dipolaarinen hetki
2,72 d.
Aallonpituudet (λ) maksimaalisen imeytymisen vedessä
225 nm ja 282 nm (ultraviolettivalo).
Polymerointi
Butanal voi polymeroitua kosketuksessa emäksisen tai hapon kanssa, koska se on vaarallinen polymerointi.
Reaktiivisuus
Kun altistetaan ilmalle hapettuneelle, muodostaen butrisarihappoa. 230ºC lämpötilassa butanali on spontaanisti tulehtunut ilmalla.
Aldoton tiivistyminen
Kaksi butanaalimolekyyliä voi reagoida toisiinsa, KOH: n läsnä ollessa ja lämpötila 6-8 ºC, yhdisteen 2-etyyli-3-hydroksiheksanolin muodostamiseksi. Tätä yhdistelmätyyppiä kutsutaan aldoliksi, koska sen rakenteessaan on aldehydiryhmä ja alkoholiryhmä.
Synteesi
Butanal voi tapahtua N-butyylialkoholin katalyyttisellä dehydralla; Krotonaldehydin katalyyttinen hydraus; ja propeenin hydroformilaatio.
Sovellukset
Teollisuuden edustajat
-Butanal on teollisuusliuotin, mutta se on myös välittäjä muiden liuottimien synteesissä; Esimerkiksi 2-etyyliheksanoli, N-butanoli ja trimetyylipropaani.
-Sitä käytetään myös välittäjänä synteettisten hartsien kehittämisessä, muun muassa butiraalinen polyvinil; kumin vulkanoinnin kiihdyttimet; lääketuotteiden valmistus; tuotteet sadon suojaamiseksi; torjunta -aineet; antioksidantit; Brking -avustajat.
-Butanalia käytetään raaka -aineena synteettisten aromien kehittämiseen. Lisäksi sitä käytetään ruoan aromiaineena.
Se voi palvella sinua: natriumbromidi (NABR)Toiset
-Ihmisessä butaania käytetään biomarkkerina, joka osoittaa hapetusvaurioita, joita lipidit, proteiinit ja nukleiinihappot ovat kokeneet.
-Sitä käytettiin kokeellisesti yhdessä muodollisen ja gluterdehydin kanssa yrittämään vähentää naudanlihan kypärien pehmenemistä vettä, virtsaa ja itse karjan ulosteita altistumisen vuoksi. Koetulokset olivat positiivisia.
Riskejä
Butanaali on tuhoisa ylähengitysteiden limakalvojen kudoksen kalvoille, samoin kuin iho- ja silmille.
Kosketuksella ihon kanssa tuottaa punoitusta ja palovammoja. Silmissä samat vauriot tuotetaan kipu ja silmäkudoksen vaurioita.
Butanaalisella hengityksellä voi olla vakavia seurauksia, koska se voi tuottaa kurkunpään ja tulehduksen ja turvotuksen keuhkoputkien; Keuhkoissa ollessaan se tuottaa kemiallista keuhkokuumetta ja keuhkoödeemaa.
Ylivalotusmerkit käsittävät: ardorinsaatiot ylähengitysteissä, yskä, hengityksen vinkuminen, eli pillin päästö hengittäessään; kurkunpääntulehdus, hengityksen puute, päänsärky, pahoinvointi ja myös oksentelu.
Hengitys voi olla kohtalokas korjausteiden kouristuksen seurauksena.
Butanaalin nauttiminen aiheuttaa "polttamisen" tunnetta ruuansulatuksella: suun onkalo, nielu, ruokatorvi ja vatsa.
Viitteet
- Morrison, r. T. Ja Boyd, R. N. (1987). Orgaaninen kemia. (5ta Painos.-A. Toimitus Addison-Wesley Iberoamericana.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Pubchem. (2019). Bunaali. Toipunut: Pubchem.NCBI.Nim.NIH.Guv
- Wikipedia. (2019). Bunaali. Palautettu: on.Wikipedia.org
- Kemiallinen kirja. (2017). Bunaali. Palautettu: Chemicalbook.com
- Basf. (Toukokuu 2017). N-butyraldehydi. [PDF]. Haettu: liuottimet.Basf.com
- « Ensisijainen hiilihiiliominaisuudet, tyypit ja esimerkit
- Olennainen koulutusominaisuudet ja miten se saavutetaan »

