Kadmium (CD) Historia, ominaisuudet, rakenne, käyttää

- 2723
- 842
- Mr. Clifford Kshlerin
Hän kadmium (CD) on atominumeron 48 ja hopeavärin siirtymä- tai siirtymävaiheen siirtymävaiheinen metalli. Se on muokattavissa ja ulottuva, suhteellisen alhaisella sulatus- ja kiehumispisteellä. Kadmium on harvinainen elementti, ja sen pitoisuus on tuskin 0,2 g / tonnia maapallon kuorta.
La Greenockita (CDS) on ainoa tärkeä kadmiumin MENA, jolla on voimakas keltainen väri. Kadmium liittyy sinkkiin sfaleriitissa (ZNS), joka sisältää 0,1 - 03 % kadmiumia CD -kationina2+.
 Kadmiumkiteet. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]
Kadmiumkiteet. Lähde: Hi-Res-kuvat kemiallisista elementeistä [CC 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)] Käsitellessä sfannelia sinkin hankkimiseksi, valimo ja puhdistaminen, kadmium saadaan toissijaisesti, tämä on sen tärkein tuotantolähde.
Friedrich Stromayer ja Karl Hermann löysivät tämän metallin vuonna 1817 itsenäisesti. Stromayer kastoi uuden elementin kadmiumin nimellä, joka oli peräisin latinalaisesta sanasta "cadmia", termi kalamiinina (sinkkikarbonaatti) tunnetaan (sinkkikarbonaatti).
 Kadmium on kemiallinen elementti, jolla on CD -symboli ja sen atomiluku on 48. Lähde: Albedo-UKR CC BY-SA 2.5 (http: // creativecommons.Org/lisenssit/by-SA/2.5/)
Kadmium on kemiallinen elementti, jolla on CD -symboli ja sen atomiluku on 48. Lähde: Albedo-UKR CC BY-SA 2.5 (http: // creativecommons.Org/lisenssit/by-SA/2.5/) Kadmium on osa suurta hyödyllisyyttä ja lukuisia sovelluksia, kuten antikorroosivia rautaa, terästä ja ei -rautametalleja; käyttää pigmenttiä; PVC -stabilointi; Elementti hitsauksissa käytetyissä seoksissa; Nikkeli-kadmiumparistot ladattavat jne.
Se on kuitenkin erittäin myrkyllinen elementti, joka aiheuttaa vakavia vaurioita keuhkoille, munuaisille ja luille, ja jopa syöpää aiheuttavat vaikutukset on osoitettu, minkä vuoksi sen käyttöä on rajoitettu. Mutta tästä huolimatta sitä on edelleen käytetty huolellisesti joissakin sovelluksissa.
[TOC]
Historia
- Kaksinkertainen löytö
Kadmiumin löysi saksalainen kemisti Friedrich Stromayer vuonna 1817 sinkkikarbonaattinäytteessä (kalamina). Samana vuonna k. S. Lens. Hermann ja J. C. H. Roloff teki saman löytön itsenäisesti, sinkkisulfidilla suoritetussa kokeessa.
On todettu, että Stromayer teki löytönsä hallituksen hakemuksen toteuttamisen aikana Hildesheimin kaupungin apteekkien tarkastamiseksi Saksassa. Sinkkioksidia, kuten nyt, käytettiin tiettyjen ihon olosuhteiden hoidossa.
Näyttää siltä, että apteekit eivät antaneet sinkkioksidia, vaan myivät sinkkikarbonaattia: raaka -aine sinkkioksidin tuotantoon. Sinkkioksidin valmistajat väittivät, että sinkkikarbonaattia kuumennettiin keltainen "sinkkioksidi".
Kadmiumioksidi
He eivät voineet myydä tätä "sinkkioksidia", koska yhdisteen väri oli yleensä valkoinen; Ja sen sijaan he myivät sinkkikarbonaattia, myös valkoista. Tämän tilanteen vuoksi Stromayer päätti tutkia väitetyn keltaisen sinkkioksidin.
Tätä varten hän lämmitti sinkkikarbonaatin näytteitä (kalamiini) ja siellä oli keltainen sinkkioksidi, kuten tietoinen. Sen analysoinnin jälkeen hän päätteli, että keltainen väri oli tuote uuden elementin metallioksidin esiintymisen vuoksi.
Tämän uuden metallioksidin purkamisen jälkeen se tuotti pelkistyksensä saavuttaen kadmiumeristyksen. Stromayer määritti tiheyden ja sai arvon 8,75 g/cm3, Lähellä tällä parametrilla tällä hetkellä tunnetun arvon (8,65 g/cm3-A.
Samoin Stromayer huomautti, että uuden elementin ulkonäkö oli samanlainen kuin platina ja että sitä oli myös monissa sinkkiyhdisteissä ja mukaan lukien puhdistetussa sinkissä.
Stromayer ehdotti "kadmiumin" nimeä latinalaisesta äänestä "Cadmia", nimi, jota kutsuttiin Calamina, Znco3.
Kadmium sinkkisulfidissa
Karl Hermann (1817) löysi upottamattoman keltaisen värin, kun hän jalostettiin sinkkisulfidia ja ajatteli, että se voisi olla saastuminen arseenilla. Mutta kun tämä mahdollisuus hylättiin, Hermann tajusi, että hän oli uuden elementin läsnäollessa.
- Sovellukset
1840-1940
1840 -luvulla kadmiumin käyttö alettiin hyödyntää pigmentinä. Britannian farmaseuttinen Codex osoittaa vuonna 1907 kadmiumjodidin käytön lääkkeenä ”laajentuneiden nivelten”, scrofulour -rauhasten ja sabañonien hoitamiseksi.
1930- ja 1940 -luvulla kadmiumin tuotanto oli tarkoitettu teräs- ja raudan platinalle korroosion suojaamiseksi. 1950 -luvulla käytettiin kadmiumyhdisteitä, kuten kadmiumsulfidi ja kadmiumselenidi punaisina, oransseina ja keltaisina pigmentteinä.
1970-1990
1970- ja 1980 -luvulla havaittiin, että kadmiumkadmium- ja stearaattiyhdisteet olivat PVC -stabilointiaineita, jotka tuottivat kadmiumin kysynnän lisääntymisen. Kadmiumin toksisuudesta johtuvat ympäristömääräykset.
1980- ja 1990-luvuilla kadmium lopetti monien sen sovellusten käytön, mutta sitten sen tuotanto kasvoi nikkelikakadmiumin ladattavien akkujen luomisen myötä, jotka tulivat 80 % kadmiumin kulutuksesta Yhdysvalloissa.
Voi palvella sinua: Alceans -käyttö ja sovelluksetKadmiumin fysikaaliset ja kemialliset ominaisuudet
Ulkomuoto
Sileä ja pehmeä harmaa -matovalkoinen. Se tulee hauras altistuksella 80 ºC: lle, kykenee leikkaamaan veitsellä. On muokattavissa ja rullat voidaan muodostaa hänen kanssaan.
Vakioatomipaino
112 414 U
Atominumero (z)
48
Elementtiluokka
Translanssien jälkeinen metalli, vuorotellen pidetään siirtymämetallina. Siirtymämetallin IUPAC: n määritelmä on sellainen, jonka atomeilla on epätäydellinen alakohta tai joka voi johtaa kationeihin, joilla on epätäydellinen alakohta.
Tämän määritelmän mukaan kadmium ei ole siirtymämetalli sen CD -kationin jälkeen2+ Sen 4D -kiertoradalla on täysin täynnä elektroneja (4D10-A.
Haju
Käymälö
Sulamispiste
321.07 ºC
Kiehumispiste
767 ºC
Tiheys
Ympäristön lämpötila: 8,65 g/cm3
Sulamispisteessä (neste): 7 996 g/cm3
Sulamislämpö
6,21 kJ/mol
Höyrystyslämpö
99,87 kJ/mol
Molaarinen kalorikapasiteetti
26 020 J/(mol · k)
Elektronegatiivisuus
1.6 Pauling -asteikolla
Ionisaatioenergiat
Ensimmäinen: 867,8 kJ/mol (CD+ kaasumainen)
Toinen: 1631,4 kJ/mol (CD2+ kaasumainen)
Kolmas: 3616 kJ/mol (CD3+ kaasumainen)
Lämmönjohtokyky
96,6 w/(m · k)
Vastustuskyky Sähköinen
72,7 nω · m 22 ° C: ssa
Kovuus
2.0 MOHS -asteikolla. Se on metalli, vaikkakin tiheä, huomattavasti pehmeä.
Vakaus
Märkä ilma hapettaa hitaasti kadmiumoksidin muodostamiseksi, mikä tuhoaa sen metallisen kirkkauden. Se ei ole syttyvä, mutta pölyn muodossa se voi polttaa ja kokea itsemurhaa.
Itsenäinen
250 ºC kadmiumille on pölymuoto.
Taitekerroin
1,8 - 20 ºC
Reaktiivisuus
Kadmium voi polttaa ilmassa kadmiumoksidin (CAO), ruskean amorfisen pölyn muodostamiseksi, kun taas kiteinen muoto on tummanpunainen.
Kadmium reagoi nopeasti laimennetulla typpihapolla ja hitaasti kuumalla suolahapolla. Hän pystyy myös reagoimaan rikkihapon kanssa, mutta ei reagoi alkalin kanssa. Kaikissa näissä reaktioissa muodostetaan vastaavien anionien kadmiumsuolat (Cl-) tai oksoanionit (ei3- Ja niin42--A.
Elektroninen rakenne ja kokoonpano
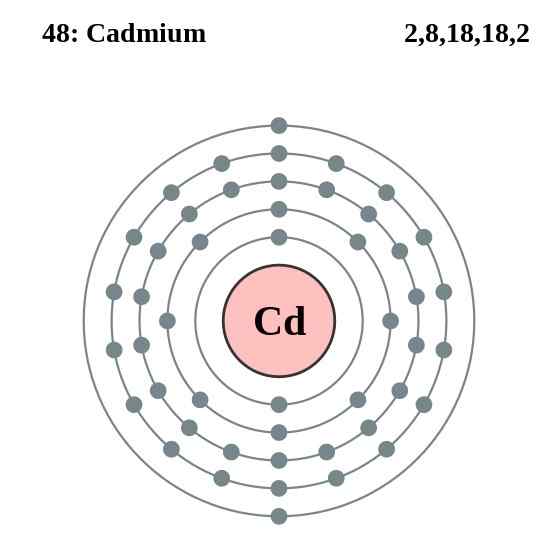 Kadmiumelektronikerroskaavio, elementti 48 jaksollisessa taulukossa. Lähde: Pumbaa (Greg Robsonin alkuperäinen teos) CC BY-SA 2.0 (http: // creativecommons.Org/lisenssit/by-SA/2.0/)
Kadmiumelektronikerroskaavio, elementti 48 jaksollisessa taulukossa. Lähde: Pumbaa (Greg Robsonin alkuperäinen teos) CC BY-SA 2.0 (http: // creativecommons.Org/lisenssit/by-SA/2.0/) Niiden lasin kadmiumiatomit luovat metallisidoksen valenssielektroneistaan, jotka sijaitsevat 4D- ja 5S -kiertoradalla niiden elektronisen kokoonpanon mukaan:
[KR] 4d10 5s2
Vaikka 4D -orbitaalit ovat täynnä elektroneja ja että voidaan myös ajatella, että ”elektronien meri” on runsaasti CD -atomien voimakkaasti, vuorovaikutukset ovat heikkoja. Tämä voidaan osoittaa kokeellisesti sen alhaisella sulamispisteellä (321 ºC) verrattuna muihin siirtymämetalleihin.
Siksi kadmiumia ei joskus pidetä siirtymämetallina, ja muut kemialliset syyt. Metallisidokseen on mukana niin paljon elektroneja (kaksitoista), jotka alkavat häiritä niiden negatiivisia torjuntoja; joka yhdessä 4D-kiertoradan ja 5S: n välisen energiaeron kanssa heikentää CD-CD-vuorovaikutusta.
CD -atomit lopulta määrittelee kompakti kuusikulmainen kiteinen rakenne (HCP), joka ei kärsi vaihesiirtymistä ennen sen sulamispistettä. Kun kadmium HCP -kiteitä käydään paineessa, joka vastaa 10 GPA: ta, rakenne on vain muodonmuutos; Mutta ilmoittamatta mitään vaihemuutosta.
Hapetusluvut
Kadmium ei voi menettää Valencian 12 elektronia; Itse asiassa et voi edes kadottaa yhtä sen 4D -kiertoradalla, energiaa vakaampi verrattuna 5: n kiertoradalle. Siksi voit menettää vain kaksi kiertoradan elektronia 5s2, Näin ollen kaksiarvoinen metalli; Kuten sinkki, elohopea- ja alkalimetallit (MR. Scholambara).
Kun CD -kationin olemassaolo oletetaan sen yhdisteissä2+, Sitten sanotaan, että kadmiumilla on +2 hapettumisnumero tai tila. Tämä on sen tärkein hapettumisnumero. Esimerkiksi seuraavat yhdisteet sisältävät kadmiumia AS +2: CDO (CD2+JOMPIKUMPI2-), CDCL2 (CD2+Cl2-), CDSO4 (CD2+Sw42-) ja CD (ei3-A2.
Tämän hapettumisnumeron lisäksi on myös +1 (CD+) ja -2 (CD2--A. Hapetusnumero +1 havaitaan CD -levyissä22+, jossa jokaisella kadmiumiatomilla on positiivinen kuorma. Samaan aikaan -2 on melko outo, ja se haki anionia "cadmuro".
Missä se on ja saa
 Greenockita -kiteet. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Greenockita -kiteet. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Kadmium on harvinainen elementti, jonka pitoisuus on 0,2 g / tonnia maapallon kuorta. Ainoa tärkeä kadmiumin mineraali on Greenockita (CD), jota ei voida hyödyntää kaivos- ja kaupallisesta näkökulmasta.
Voi palvella sinua: Flokkulaatio: Reaktio, tyypit, sovellukset, esimerkitKadmium liittyy sinkkiin Spheny -mineraalissa (ZNS), joka sisältää yleensä pitoisuuden, joka vaihtelee välillä 0,1 % - 0,3 %; Mutta joissain tapauksissa kadmiumpitoisuus sfaleriitissa voi saavuttaa 1,4 %.
Käsitellyillä kiveillä fosforilannoitteiden saamiseksi voi olla kadmiumpitoisuus 300 mg / kg lannoitetta. Hiili voi sisältää myös pieniä, mutta merkittäviä määriä kadmiumia.
Tärkeä kadmiumlähde on vulkaaniset päästöt, jotka voivat tuoda kadmiumin pintavesille. Fosforilannoitteiden käyttö maatalouden käytön maaperässä on johtanut kadmiumin saastumiseen.
Happamassa maaperässä läsnä oleva kadmium on imukyky vihanneksia. Joitakin vihanneksia käyttää ihmistä ruoana, mikä selittää, kuinka veden ja ruoan saanti on tärkein kadmiumtulojen lähde ihmisillä, jotka eivät ole ammatillisesti alttiina tai tupakointia.
Sfaleriittikäsittely
Sfaleriitissa läsnä olevan sinkin kaivostoiminnan, sulattamisen ja puhdistamisen aikana kadmium saadaan yleensä toissijaisena tuotteena. Samanlainen tapahtuma tapahtuu myös, vaikkakin paljon vähemmän, kuparin ja lyijyn käsittelyn aikana.
Samoin pieniä määriä kadmiumia voidaan saada raudan ja teräsjätteen kierrätyksestä.
Sprailusta altistetaan paahtoleipää siten, että sinkkisulfidista tulee sen oksidi, Zno. Sama reaktio kärsii kadmiumsulfidista:
2 Zns + 3 o2 → 2 ZnO + 2 niin2
Jos tämä oksidin seos lämmitetään hiilellä, ne pelkistetään vastaaviin metalleihinsa:
Zno + Co → Zn + Co2
Samoin sinkkiä ja kadmiumia voidaan tuottaa elektrolyysillä, kun liukenevat rikkihappoa.
Kumpi tahansa kahdesta menetelmästä tuottaa viisikymmentä saastuneen kadmiumilla. Sulamisen aikana kadmium voidaan tislata tyhjössä sen alemman sulamispisteen (321 ° C) vuoksi verrattuna CINC: n kanssa (420 ° C).
Isotoopit
Kadmiumin luonnollisista ja vakaista isotoopeista, joita meillä on, niiden määränsä täällä maan päällä:
-106CD (1,25%)
-108CD (0.89%)
-110CD (12,47%)
-111CD (12,8%)
-112CD (24,11%)
-114CD (28,75%)
-113CD (12,23%)
Hän 113CD on radioaktiivinen, mutta sen puolen elämän suuren arvon vuoksi (t1/2= 7,7 · 10viisitoista vuosia), voidaan pitää vakaana. Ja sitten on 116CD, myös radioaktiivinen, puoli -elämä 3,1,1019 vuosia, joten sitä voidaan pitää vakaana isotooppina, joka edustaa 7,51 % kadmiumista.
Huomaa, että keskimääräinen atomimassa on 112 414 U, lähempänä 112 kuin 114. Kadmiumissa ei havaita vallitsevaa isotooppia muiden yläpuolella.
Riskejä
Yleinen
Kadmiumin imeytyminen tapahtuu pääasiassa ruoan, erityisesti maksan, sienten, äyriäisten, jauhemaisten kaakaon ja kuivien levien kanssa.
Kiinassa tapahtui symbolinen tapaus viime vuosisadalla, missä väestössä oli tärkeä pilaantuminen kadmiumin kanssa. Kadmiumin pilaantuminen johtui sen korkeasta pitoisuudesta riisissä, mikä johtui kadmiumin esiintymisestä viljaviljelymaassa.
Tupakoitsijan keskimääräinen saanti on 60 µg / päivä. Veressä sallitun kadmiumin enimmäispitoisuus on 15 ug / päivä. Ei -tupakoitsijoilla on veressä kadmiumpitoisuus noin 0,5 ug / l.
Keuhkot absorboivat 40–60 % tupakansavussa olevasta kadmiumista. Keuhkoihin absorboitu kadmium kuljetetaan veressä, muodostaen komplekseja proteiinien, kysteiinin ja glutanan kanssa, jotka päättyvät sitten maksaan, munuaiseen jne.
Akuutti kadmiumin hengitys voi aiheuttaa oireita, jotka ovat samanlaisia kuin influenssaprosessissa havaittu; kuten kylmä, kuume ja lihaskipu, kyky aiheuttaa keuhkovaurioita. Samaan aikaan krooninen altistuminen kadmiumille voi aiheuttaa keuhkosairauksia, munuaisia ja luita.
Vaikutus munumiin
Munuaisissa kadmium aiheuttaa yleensä fosforin ja kalsiummetabolian muutoksia, mikä käy ilmi munuaislaskelmien tuotannon kasvusta. Lisäksi se aiheuttaa munuaisvaurioita, jotka ilmenevät retinolikuljetinproteiinin ja β-2-mikroglobuliinin virtsassa.
Lisääntymisvaikutus
Äidin altistuminen kadmiumille liittyy lapsen alhaiseen painoon syntymän yhteydessä ja spontaanien aborttien määrän lisääntyminen.
Luuvaurio
Kadmium liittyy Japanissa Itai -Itai -taudin esiintymiseen viime vuosisadalla. Tälle sairaudelle on ominaista alhainen luun mineralisaatio, luun hauraus, jolla on korkea murtuma, lisääntynyt osteoporoosi ja luukipu.
Voi palvella sinua: CD3: Ominaisuudet, toiminnotKarsinogeneesi
Vaikka roti -kokeet ottivat yhteyttä kadmiumin ja eturauhassyövän välillä, sitä ei ole osoitettu ihmisillä. Kadmiumin ja munuaissyövän välinen yhteys on todistettu, ja se on myös liitetty keuhkosyöpään.
Sovellukset
Nikkelikadmium ladattavat bakteerit
 Eri paristot tai Ni-CD-akut. Lähde: Boffy B Wikipedian kautta.
Eri paristot tai Ni-CD-akut. Lähde: Boffy B Wikipedian kautta. Kadmiumhydroksidia käytettiin katodina Ni-CD-paristoissa. Niitä käytettiin rautatie- ja ilmailuteollisuudessa sekä kollektiivisen käytön välineissä, jotka sisältävät matkapuhelimet, videokamerat, kannettavat tietokoneet jne.
Kadmiumkulutus Ni-CD-paristojen kehittämiseksi edusti 80 % kadmiumintuotannosta. Tämän elementin toksisuuden vuoksi NI-CD.
Pigmentit
 Kadmiumpunainen. Lähde: Marco Almbauer [julkinen alue]
Kadmiumpunainen. Lähde: Marco Almbauer [julkinen alue] Kadmiumsulfidia käytetään keltaisena pigmentinä ja kadmium Seleniurona punaisena pigmentinä, joka tunnetaan nimellä Cadmio Red. Näille pigmenteille on ominaista niiden loisto ja intensiteetti, joten niitä on käytetty muoveissa, keramiikassa, lasissa, emaloissa ja taiteellisissa väreissä.
On huomautettu.
Kadmipigmenttien väri on heikentynyt ennen kuin ne jauhetaan öljyjen kanssa tai sekoitettuna vesiväriin ja akryyleihin.
Televisio
Kadmiumia sisältäviä komponentteja käytettiin mustan ja valkoisen televisioiden fosforissa, samoin kuin sinisissä ja vihreissä vastaavissa värien televisioputkissa.
Fosfori oli osa sitä seulaa, jonka säteili katodisäteet, jotka olivat vastuussa kuvanmuodostuksesta. Kadmiumia on myrkyllisyydestään huolimatta alkanut käyttää viimeaikaisen luomisen Qled -televisioissa.
PVC -stabilointi
Karboksylaattia, laatitulla ja ohjausaineella muodostettuja kadmiumyhdisteitä käytettiin polyvinyylikloridi -stabilointiaineena, koska ne viivästyttävät hajoamista, joka on tuotettu altistumisella lämpö- ja ultraviolettivalolle, joka hajottaa PVC: n sen valmistusprosessin aikana.
Kadmiumin toksisuuden vuoksi kadmiumiin yhdistyneiden PVC-stabilointimien avulla on korvattu muilla stabilisaattoreilla, kuten Barium, Calsium-Zinc ja Organostaño.
Seokset
Kadmiumia on käytetty lejeeringeissä, koska sen vastustuskyky on suuri väsymys- ja matala kitkakerroin. Kadmiumilla on suhteellisen matala sulamispiste, joten sitä käytetään alhaisissa sulamiseoksissa, ja se on komponentti monen tyyppisten hitsausten lisäksi.
Kadmiumia voidaan käyttää myös sähkönjohtavuuden, lämmönjohtavuuden ja sähköisen kontaktin seoksissa.
Päällyste
Kadmiumia käytetään terässuojaukseen, alumiiniin ja muihin ei -rautametallien kiinnityselementteihin sekä liikkuviin osiin. Kadmiumpäällystys toimittaa korroosionsuoja. Lisäksi se toimii voiteluaineena.
Kadmiumia käytetään myös monissa sähkö- ja elektronisissa sovelluksissa, jotka tarvitsevat korroosionkestävyyttä ja alhaisen sähkövastuksen.
Ydinreaktorit
Kadmiumia käytetään ydinreaktoreissa niiden kyvyn sieppaamiseksi, mikä mahdollistaa ylimääräisten neutronien hallinnan ydinfission tuotteen välttämiseksi, jotka välttävät ylimääräisiä ydinhalkeamia.
Puolijohteet
Seleniuro ja kadmium Telluriuro ovat yhdisteitä, jotka täyttävät puolijohteiden toiminnan valon havaitsemisessa ja aurinkokennoissa. HGCDTE on herkkä infrapunavalolle ja sitä käytetään liikkeentunnistimena, samoin kuin kauko -ohjauslaitteiden kytkin.
biologia
 He-cd laservalo. Lähde: Melko tuntematon (https: // www.Flickr.com/valokuvat/[Sähköposti suojaukset]/35766549)
He-cd laservalo. Lähde: Melko tuntematon (https: // www.Flickr.com/valokuvat/[Sähköposti suojaukset]/35766549) Helium-CD puuttuu aallonpituuden sinisen violettilasersäteen muodostumiseen, joka vaihtelee välillä 325-422 nm, joka voidaan käyttää fluoresenssimikroskoopeilla.
Kadmiumia käytetään molekyylibiologiassa kalsiumkanavien estämiseksi, riippuen kalvopotentiaalista.
Viitteet
- Wikipedia. (2019). Kadmium. Haettu: vuonna.Wikipedia.org
- Viidakko v. R -. & et ai. (2014). Nestemäisen ja kiinteän CD: n korkea paine ja lämpötilarakenne: vaikutukset CD -levyn sulamiskäyrään. Toipunut: ResearchGate.netto
- DR. Taikina. (2019). Kadmiumelementit. Toipunut: Chemicool.com
- Kansallinen bioteknologiatietojen keskus. (2019). Kadmium. Pubchem -tietokanta. CID = 23973. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Godt, j., Scheidig, f., Grosse-siestUp, c., Esche, V., Brandenburg, P., Reich, a., & Groneberg, D. -Lla. (2006). Kadmiumin toksisuus ja siitä johtuvat vaarat ihmisten terveydelle. Journal of Acrofemal Medicine and Toxicology (Lontoo, Englanti), 1, 22. Doi: 10.1186/1745-6673-1-22
- Ros Rachel. (30. heinäkuuta 2018). Fakia camiumista. Toipunut: LivesCience.com
- Enyclopaedia Britannica -toimittajat. (6. syyskuuta 2018). Kadmium. Encyclopædia britannica. Toipunut: Britannica.com
- Kansainvälinen kadmiumyhdistys. (S.F.-A. Kadmiumsovellus. Toipunut: kadmium.org
- Lentech b. V. (2019). Kadmium. Toipunut: lentech.com
- « Perussolmut toimivat, anatomia ja patologiat
- Historiaparasitologia, mitä opiskelet?, oksat, käsitteet »

