Kalmoduliinirakenne, toiminnot ja toimintamekanismi
- 4507
- 1008
- Dr. Travis Reichert
Kalmoduliini Se on termi, joka tarkoittaa "kalsiummoduloitua proteiinia" ja viittaa pieneen solunsisäiseen proteiiniin, joka omistaa kalsiumionin (CA ++) ominaisuuden ja välittää monia sen solunsisäisiä vaikutuksia. Sanan alkuperä syntyy englanninkielisten sanojen 'kalsium', 'moduloitu' ja 'proteiini' yhdistelmästä, jotka yhdessä saadaan aikaan LIMECium ModuuliProtettiSisään.
Niiden mineraalielementtien joukossa, jotka tulevat osaksi eläinten organismien perustuslakia, kalsiumia, jota seuraa fosfori, on paljon erilainen kuin runsain, koska luu muodostuu sen matriisissa suurten mineraalisuolojen matriisissa ioni.
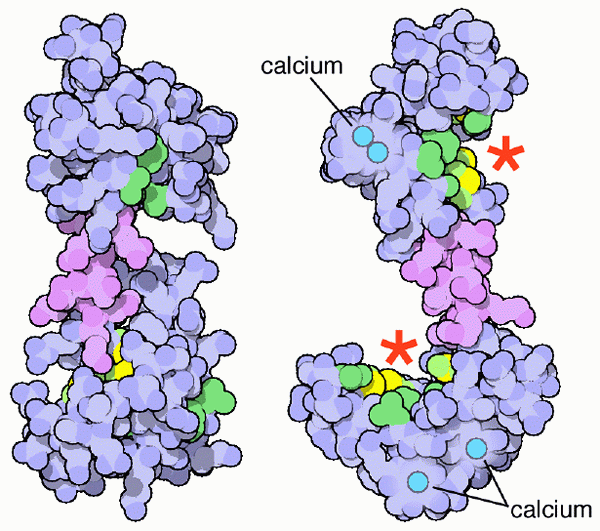
 Palmoduliinijärjestelmä ja sen kalsiumyhdistyspaikat (lähde: PDB [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Palmoduliinijärjestelmä ja sen kalsiumyhdistyspaikat (lähde: PDB [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Nämä kalsiumin mineraalisuolat ovat tietysti välttämättömiä selkärankaisten luuston järjestelmän perustuslain ja konformaation kannalta, mutta se on kehon nesteiden liuoksen ionisoitu kalsiumimuoto (CA ++), josta tulee fysiologinen merkitys, joka liittyy elämään organismien elämä.
Tämä kationi, jossa rakenteessaan kaksi positiivista sähkövarausta, voi toimia nykyisenä kuljettimena liikkuessaan solukalvon läpi ja modifioida sen sähköpotentiaalin tasoa monissa kehon herättävissä soluissa, pääasiassa sydämen lihaksessa.
Mutta suurempi fysiologinen merkitys on se, että monet ulkoisten ärsykkeiden, kuten neurotransmitterit, hormonit tai muut fysikaaliset tai biokemialliset tekijät, potkut solun säätelyreaktiot ovat metabolisia vesiputouksia, joissa useita proteiineja osallistuu peräkkäin, joista jotkut ovat entsyymejä, jotka ovat entsyymejä jotka ovat entsyymejä, jotka ovat entsyymejä, ne vaativat kalsiumia aktivointia tai inaktivointia varten.
Näissä tapauksissa sanotaan, että kalsium toimii toisena lähettiläänä aineenvaihduntavesiputouksessa, jonka tavoitteena on saada lopullinen tulos, josta tulee tarvittava soluvaste vastaavan tarpeen tyydyttämiseksi toisella tasolla kuin itse solu ja joka vaatii häneltä Tämä vastaus.
Kalsium voi toimia suoraan sen biokemiallisessa tavoitteessa vaikuttamaan sen aktiivisuuteen, mutta se vaatii usein sen proteiinin osallistumista, johon se on yhdistettävä voidakseen vaikuttaa sen vaikutukseen proteiineihin modifioimaan. Palmoduliini on yksi niistä välittävistä proteiineista.
[TOC]
Rakenne
Kalalmoduliini, suurella yleisesti, koska se ekspressoituu melkein kaikissa eukaryoottisten organismien solutyypeissä, se on pieni happoproteiini, joka on noin 17 kDa: n molekyylipaino, jonka rakenne on erittäin säilynyt lajien keskuudessa.
Voi palvella sinua: Ionikanavat: rakenne, toiminnot, tyypitSe on monomeerinen proteiini, toisin sanoen se muodostuu yhdellä polypeptidiketjulla, joka ottaa käyttöön sen terminaalissa, päättyy alfa -potkurin yhdistämien globaalien domeenien muotoon,. Jokaisella palloalueella on kaksi syytä, jotka tunnetaan nimellä EF -käsi (englannista EF Käsi), jotka ovat tyypillisiä proteiineille, jotka sitoutuvat kalsiumiin.
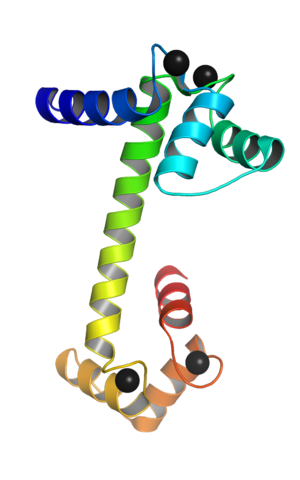 Kalsiumioneihin kytketty kalvoduliini (lähde: Webridge [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Kalsiumioneihin kytketty kalvoduliini (lähde: Webridge [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Nämä ”EF” topologiset motiivit edustavat eräänlaisia supersecundaria -rakenteita; Ne on kytketty toisiinsa, jokaisessa pallomaisessa domeenissa, suurella joustavuudella ja jokaisessa niistä on Ca ++: n liitoskohde, joka heittää yhteensä 4 kohtaa jokaiselle kalmoduliinimolekyylille.
Kalsiumionien liitto, positiivisella kuormituksella, on mahdollista aminohappojätteen läsnäolon ansiosta sivuttaisketjuilla, jotka on negatiivisesti varautuneita kalsiumin kalsiumin kalsiumyhdistyspaikoissa. Tämä jäte on kolme aspartaattia ja glutamaatti.
Kalmoduliinitoiminnot
Kaikki kalaloduliinista toistaiseksi tunnetut toiminnot on kehitetty toimintojen ryhmään, jota edistää sytosolisen kalsiumin lisääntyminen, joka on tuotettu sen sisäänkäynnistä solunulkoisesta tilasta tai sen poistumisesta solunsisäisistä kerrostumista: mitokondrioista ja endoplasmisesta retikulumista.
Tämä ioni toteuttaa monet kalsiumvaikutukset, jotka vaikuttavat suoraan sen valkoisiin proteiineihin, jotka voivat olla monipuolisia ja toimintoja. Joitakin näistä proteiineista ei voida vaikuttaa suoraan, mutta vaatii, että kalsium liittyy kalmoduliiniin ja juuri tämä kompleksi vaikuttaa proteiiniin, johon ioni vaikuttaa.
Näistä valkoisista proteiineista sanotaan, että ne ovat riippuvaisia kalsiumkalmoduliinia ja heidän joukossaan kymmeniä entsyymejä, kuten proteiineja, proteinfosfaasi, nukleotidisyklassit ja fosfodiesteraasit; Kaikki osallistuvat lukemattomiin fysiologisiin toimintoihin, jotka sisältävät:
- Aineenvaihdunta
- Hiukkasten kuljetus
- Viskeraalinen liikkuvuus
- Päihteiden eritys
- Munasolun hedelmöitys
- Geneettinen ilmentyminen
- Solujen lisääntyminen
- Solujen rakenteellinen eheys
- Solunvälinen viestintä jne.
Kalalmoduliiniriippuvaisten proteiinien joukossa mainitaan: myosiinin (MLCK) kevyen ketjun cinase, Cinase -fosforylaasi ja CA ++/Calmodulin Cinasas I, II ja III.
Siten kalsiumsignaalien koodaavat tiedot (sen solunsisäisen konsentraation lisääminen tai väheneminen) ovat "purkaminen" tällä ja muilla kalsiumyhdistysproteiineilla, jotka tekevät signaaleista biokemialliset muutokset; Toisin sanoen kalmoduliini on välittäjäproteiini kalsiumista riippuvissa signalointiprosesseissa.
Voi palvella sinua: Glut 2: Ominaisuudet, rakenne, toiminnotToimintamekanismi
Palmoduliini on erittäin monipuolinen proteiini, koska sen "kohde" -proteiinit ovat muodoltaan, sekvensseissä, koossa ja toiminnassa huomattavasti monimuotoisia. Koska se on proteiini, joka toimii kalsiumionien "anturina", sen vaikutuskanismi riippuu sen rakenteessa ja/tai konformaatiossa aiheutuvista muutoksista, kun se liittyy neljään näistä ionista.
Sen toimintamekanismeja voidaan esimerkkejä tarkistamalla lyhyesti heidän osallistumistaan pariin fysiologisiin prosesseihin, kuten viskeraalisen sileän lihaksen supistumiseen ja sopeutumiseen hajujen nenäsolujen nenäsoluihin, nenässä.
Kalmoduliini ja sileä lihaksen supistuminen
 Myosiinin ristiinnauhojen ja kalmoduliinin rakenne mikrotaallissa aktiinipalkeissa. Lähde: Jeffrey W. Ruskea, c. James McKnight [CC by (https: // creativecommons.Org/lisenssit/by/3.0)]
Myosiinin ristiinnauhojen ja kalmoduliinin rakenne mikrotaallissa aktiinipalkeissa. Lähde: Jeffrey W. Ruskea, c. James McKnight [CC by (https: // creativecommons.Org/lisenssit/by/3.0)] Luurankojen ja sydämen lihaksen supistuminen laukaisee, kun sytosolisen Ca ++. Tropomiosiini puolestaan liikkuu ja paljastaa aktiininsa unionin sivustonsa myosiinin kanssa, jolloin supistuva prosessi laukaisee.
Sileässä lihaksessa ei ole troponiinia C, ja CA ++: n nousu ilmoitetun tason yläpuolella edistää sen liitosta kalmoduliinin kanssa. CA-kalmoduliinikompleksi, joka on aktiivinen myosiinin kevyeen ketjun cinase (MLCK), joka puolestaan fosforyloituu tähän kevyeen ketjuun, aktivoi myosiinin ja laukaisee supistuvan prosessin.
Ca ++: n lisääntyminen annetaan sen sisäänkäynnin ulkopuolelta tai poistuminen sarkoplasmisesta retikulumista inositol -tryfosfaatin (IP3) vaikutuksella fosfolipaasi C: n vapauttamalla GQ -proteiinin kytkettyihin reseptoreihin aktivoimassa vesiputouksessa vesiputouksessa. Relaksaatio tapahtuu, kun CA ++ poistetaan kuljetustoiminnalla sytosolista ja palaa lähdepaikkoihinsa.
Tärkeä ero molempien supistumistyyppien välillä on, että raidottuissa lihaksissa (sydämen ja luuranko) Ca ++ indusoi alesteriset muutokset liitettäessä sen proteiinia, troponiinia, kun taas CA-kalmoduliinin tuottamat muutokset ovat kovalenttisia ja impyyneitä merkitse myosiinin fosforylaatiota.
Siksi, kun CA ++ -toiminta on valmis, CINASA: n lisäämä fosfaatin osallistuminen vaaditaan toisen entsyymin. Tämä uusi entsyymi on myosiinin kevyen ketjun (MLCP) fosfataasi, jonka aktiivisuus ei riipu kalvomoduliinista, vaan sitä säätelevät muut tiet.
Itse asiassa supistuva sileä lihasprosessi ei lopu, mutta supistumisaste ylläpidetään väliaikaisesti, mikä johtaa molempien entsyymien toimien tasapainon, CA ++: n ja kalmoduliinin hallitseman MLCK: n ja muille toimitettujen MLCP sääntelyvalvonta.
Voi palvella sinua: PachyneSopeutuminen hajuantureihin
Hajuinen tunne laukaisee, kun hajujen pinnalla sijaitsevien solujen silikoissa sijaitsevat hajureseptorit aktivoidaan.
Nämä reseptorit on kytketty heterotrofiseen G -proteiiniin, joka tunnetaan nimellä "golf" (G -hajuproteiini), jolla on kolme alayksikköä: "αolf", "ß" ja "y".
Kun hajureseptorit aktivoituvat vasteena hajulle, tämän proteiinin alayksiköt dissosioituvat ja alayksikkö “aolf” aktivoi adenyylisiklaasientsyymin, joka tuottaa adenosiinisyklistä monofosfaattia (AMPC) (AMPC).
AMPC aktivoi CNG -tyyppikanavat (aktivoitu sykliset nukleotidit) kalsiumin ja natriumin suhteen. Nämä ionit tulevat soluun, depolarisoivat sen ja aiheuttavat toimintapotentiaalien alkamisen, joiden taajuus määrittää hajun voimakkuuden.
Tulossa olevalla kalsiumilla, jolla on taipumus depolarisoida solua, on negatiivisen palautteen antagonistinen vaikutus jonkin verran myöhemmin liittymällä kalmoduliiniin ja niiden välillä kanavan sulkeminen ja depolarisoivan ärsykkeen poistaminen huolimatta siitä tosiasiasta, että hajuinen ärsyke jatkuu jatkuu. Tätä kutsutaan anturin sopeutumiseksi.
Kasveissa
Kasvit reagoivat myös solunsisäisiin pitoisuuseroja kalsiumioneista kalvoduliiniproteiinin avulla. Näissä organismeissa kalmoduliineilla on monia rakenteellisia ja toiminnallisia ominaisuuksia eläinten ja hiivojen vastaavien kanssa, vaikka ne eroavat eräistä funktionaalisista näkökohdista.
Esimerkiksi kasvien kalmoduliini liittyy lyhyisiin peptidisekvensseihin sen valkoisissa proteiineissa indusoimalla rakenteellisia muutoksia, jotka muuttavat niiden aktiivisuuksia vasteena sisäisiin kalsiumvaihteluihin.
Missä määrin kalvoduliinin hallinta kasveissa analogiset prosessit, joihin niitä esiintyy eläimissä, on jotain, joka on edelleen keskustelun aihe.
Viitteet
- Brenner B: Musculatur, julkaisussa: Fysiologia, 6. painos; R Klinke et ai (toim.). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: Lääketieteellisen fysiologian molekyylipohja, julkaisussa: julkaisussa: Katsaus lääketieteelliseen fysiologiaan, 25. ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: Johdatus endokrinologiaan, julkaisussa: Lääketieteellisen fysiologian oppikirja, 13. ed, AC Guyton, Je Hall (toim.). Philadelphia, Elsevier Inc., 2016.
- Kaup UB, Müller F: Olfactorisches System, julkaisussa: Physiologie, 4. painos; P Deetjen et ai (toim.). München, Elsevier Gmbh, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle Als Grundbaustein, julkaisussa: Fysiologia, 6. painos; R Klinke et ai (toim.). Stuttgart, Georg Thieme Verlag, 2010.
- Zielinski, r. JA. (1998). Kasveissa olevia kalmoduliinia ja kalmoduliinia sitovia proteiineja. Vuotuinen kasvibiologian katsaus, 49 (1), 697-725.

