Haihdutuslämpö

- 1557
- 55
- Louis Moen
 Haihtumisen tai höyrystymisen lämpö on se, joka kärsii kemikaalista nestemäisen tilan muuttamiseksi kaasumaiseksi
Haihtumisen tai höyrystymisen lämpö on se, joka kärsii kemikaalista nestemäisen tilan muuttamiseksi kaasumaiseksi Mikä on haihtumislämpö?
Hän Haihdutuslämpö, Kutsutaan myös höyrystymislämpöä, se määritellään lämmön määräksi, jonka puhdas kemia absorboi haihtumiseen, toisin sanoen, että valtion muutokset nestetilasta kaasutilaan.
Eli se on seuraava vaiheenmuutosprosessiin liittyvä lämpö:
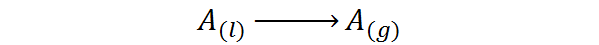
Se on tyyppi lämpöä, joka ei aiheuta lämpötilan nousua, mutta rikkoo voimia, jotka pitävät nestemolekyylit yhdessä. Tällä tavalla on mahdollista erottaa molekyylit toisistaan, vapauttaen ne kaasufaasiin.
Kaava ja yksiköt
Haihtumisen tai höyrystymisen lämpö voidaan esittää symbolin q avullaHöyry. Se on laaja määrä, eli se riippuu aineen määrästä.
Tässä mielessä se voidaan laskea aineen määrästä ja intensiivisestä haihdutuslämpömittauksesta.
Kun aineen määrä ilmaistaan massan muodossa, on käytettävä piilevää haihtumisen tai höyrystymisen lämpöä, lHöyry, Tällöin haihtumislämpö ilmaistaan seuraavasti:
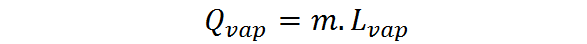
Höyrystymisen piilevä lämpö on intensiivinen ja ominainen määrä jokaista ainetta. Se on enemmän tai vähemmän suora mitta siitä, kuinka vahvat molekyylien väliset vuorovaikutukset ovat nesteen muodostavien hiukkasten välillä.
Toisaalta höyrystymislämpö voidaan myös laskea moolien lukumäärästä, jolloin tarvitaan höyrystymisen molaarista lämpöä, jota kutsutaan myös höyrystymisen entalpiaksi:
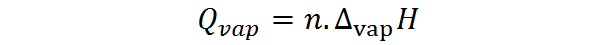
Missä n edustaa moolien lukumäärää ja ∆HöyryH on aineen höyrystymisen entalpia. Höyrystymisen entalpia edustaa vakiopaineen määrää, jota tarvitaan aineen moolin haihtumiseen.
Se voi palvella sinua: propaanihappoHöyrystyslämpöyksiköt
Koska lämpö on eräänlainen energia, haihdutuslämpö ilmaistaan energiayksiköissä. Yleisimmin käytetyt yksiköt ovat:
- Kalorit (lime)
- Kilokalorit (kcal tai kalkki)
- Jouls tai Joules (J)
- Kilojouls tai kilojulios (KJ) jne.
Toisaalta haihtumisen piilevä lämpö (LHöyry) Se ilmaistaan massaenergiayksiköissä. Esimerkiksi:
- lime/g
- Kcal/g
- Kcal/kg
- KJ/G
- KJ/kg, jne.
Lopuksi höyrystymisen entalpia (∆HöyryH) Se ilmaistaan energiayksiköissä aineen määrän yksiköissä, yleensä moolit. Joitakin esimerkkejä ovat:
- lime/mol
- Kcal/mol
- J/mol
- KJ/mol jne.
Kuinka haihdutuslämpö lasketaan?
Kuten hetki sitten näimme, haihdutuslämpö voidaan laskea moolien massasta tai lukumäärästä ja vastaavasti piilevästä haihtumislämmöstä tai höyrystymisen entalpiasta.
Nämä määrät määritetään kuitenkin yleensä kokeellisesti mittaamalla tarvittavan lämmön määrän tietyn aineen massan haihduttamiseksi ja sitten yhden kahdesta aiemmasta yhtälöstä puhdistamiseksi.
Edellä esitetyn vuoksi yleinen asia ei ole se, että höyrystymisen lämpö lasketaan, vaan että se mitataan kokeellisesti, laboratoriossa.
Toisaalta, koska entalpia, koska järjestelmän termodynaaminen ominaisuus on tilafunktio, tämä voidaan laskea muista entalpilaisista, jotka liittyvät nestemäisessä tilassa, jolla on sama aine kaasumaisessa tilassa.
Esimerkiksi höyrystymisen entalpia voidaan laskea vähentämällä sublimointiharrastaja paitsi aineen fuusio entalpia. Sitten tätä entalpiaa ja moolien lukumäärää käytetään näytteen haihtumislämmön määrittämiseen.
Voi palvella sinua: alumiinipolykloridi: rakenne, ominaisuudet, hankkiminen, käyttöHöyrystyslämpösovellukset
On monia kenttiä, joilla haihdutuslämpöä käytetään. Itse asiassa kaikissa prosesseissa, joihin liittyy kemikaali, joka kerralla on nestemäisessä tilassa ja toisessa kaasumaisessa tilassa, haihtumislämpö puuttuu asiaan.
Haihdutuslämpö on aina positiivista, koska on aina tarpeen absorboida lämpöä katkaisemaan nesteen muodostavien molekyylien välinen liitto. Aine imee tämän lämmön välittömästä ympäristöstä, joten ne menettävät lämpöä, kun neste haihtuu.
Höyrystyslämpö- ja kehon lämpötilan säätely
Tämä on hikoilun toiminnan periaate kehon lämpötilan säätelyjärjestelmänä.
Kun hikoilemme, hiki vesi haihtuu ihomme pinnalle. Koska iho on suorassa kosketuksessa hiki, siellä vesi saa haihdutuslämpöä.
Sitten haihtuessaan hikivesi kantaa mukanaan määrän ihon lämpöä, joka jäähdyttää, myös jäähdyttäen veren, joka virtaa ihon kapillaarien ja viime kädessä kehon sisätilojen läpi.
Haihdutuslämpö teollisuudessa
Energia on yksi monien teollisuudenalojen suurimmista kustannuksista, ja monien niistä on käytettävä energiaa erilaisten aineiden haihduttamiseen. Tästä syystä on välttämätöntä laskea erilaisten nesteiden haihduttamiseen tarvittava lämmön määrä käyttökustannusten laskemiseksi.
Esimerkiksi, jos lääkeyhtiö syntetisoi lääkityksen alkoholiliuoksessa, sen on todennäköisesti haihduttava ja kuivattava tuote kaikkien alkoholin poistamiseksi. Haihdutuslämpö antaa meille mahdollisuuden määrittää, kuinka paljon energiaa tämän toteuttamiseksi tarvitaan.
Se voi palvella sinua: periódiinihappo (HIO4): Mikä on, rakenne, ominaisuudet, käyttötarkoituksetJäänvalmistus junassa
Ennen sähkön olemassaoloa junat käyttivät haihdutuslämpöä veden jäädyttämiseen ja siten jäävät matkan aikana. Prosessi on samanlainen kuin hikoilu ja toimii samalla tavalla.
Asemalla juna koukuttaa nahkapussin, joka sisältää nestemäistä vettä. Laukku ei ole täydellisesti hermeettinen, joten ulkopinta on kostutettu. Matkan aikana ilma haihduttaa veden nopeasti pussin pinnalta, absorboimalla nestemäistä vettä ja jäähdyttäen sitä, sen jäädyttämiseen.
Esimerkkejä haihtumislämpöistä
Seuraava taulukko sisältää piileviä höyrystymis- tai haihtumislämpöjä joillekin yleisille kemikaaleille.
| Aine | Piilevä höyrystymisen lämpö (LHöyry/KJ.g-1-A | Höyrystymisen entalpia (∆HöyryH/KJ.molo-1-A |
| Vesi (h2JOMPIKUMPI) | 2 260 | 40 657 |
| Etanoli (ch3CH2VAI NIIN) | 0,837 | 38.56 |
| Rikkivety (H2S) | 0,6422 | 21.90 |
Viitteet
- Ehu.Se on (s. F.-A. Vesihöyryn piilevä lämpö. Otettu SC: ltä.Ehu.On.
- Luz, g. (S. F.-A. Höyrystyslämpö. Otettu materiaaleista.Gelsonluz.com.
- Soler & Palau (2019). Piilevä lämpö: fuusio ja höyrystyminen. Otettu Solerpalausta.com.
- Spiegato (2021). Mikä on höyrystymisen lämpö? Otettu Spiegatosta.com.

