Kalsiumkarbonaattirakenne, ominaisuudet, muodostuminen, käyttö

- 2440
- 671
- Dr. Travis Reichert
Hän kalsiumkarbonaatti Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on Caco3. Sitä löytyy pääasiassa mineraaleista, kuten kalsiitti ja aragoniitti. Samoin kalkkikivi säveltää, sedimenttikivi, jossa kalsita mineraali on läsnä.
Tämä tärkeä metallikarbonaatti saadaan teollisesti uuttamalla ja hiomalla sitä sisältäviä mineraaleja; Tätä varten marmoria käytetään pääasiassa. Toinen prosessi on kalsiumoksidin käytössä, josta tulee kalsiumhydroksidia, saostaen kalsiumkarbonaattia lisäämällä hiilidioksidia. Tällä tavoin kiteet saadaan monista kokoista.
 Etanankuori koostuu pääasiassa kalsiumkarbonaatista. Lähde: Pixabay.
Etanankuori koostuu pääasiassa kalsiumkarbonaatista. Lähde: Pixabay. Niitä voidaan käyttää myös Caco Industrial -tuotantoon3, Pienessä mittakaavassa simpukkaiden, munankuorien ja osterikuorien kuoret, joissa sitä on.
Kalkkikivessä esiintyvä kalsiumkarbonaatti liuotetaan hiilidioksidilla veteen, tuottaen kalsiumbikarbonaattia. Tämä toiminta voi aiheuttaa luolat ja on syynä veden alkalisointiin; Elämän ylläpidossa erittäin tärkeä tapahtuma.
Sitä on käytetty veistoksien rakentamisessa ja kehittämisessä; Esimerkkejä tästä ovat Ateenan kumppani, Krakovan katedraali ja Abraham Lincolnin veistos Washingtonissa. Sen herkkyys happaan sateelle on kuitenkin vähentänyt sen käyttöä rakentamisessa.
Kalsiumkarbonaatilla on ollut useita sovelluksia teollisuudessa muovi- ja paperin täyttömateriaalina. Lääketieteessä sitä on käytetty mahahaponhappoisuuden hallintaan; ruokavalion kalsiumlisänä; Fosfatian hallitsemiseksi potilailla, joilla on krooninen munuaisten vajaatoiminta jne.
[TOC]
Rakenne
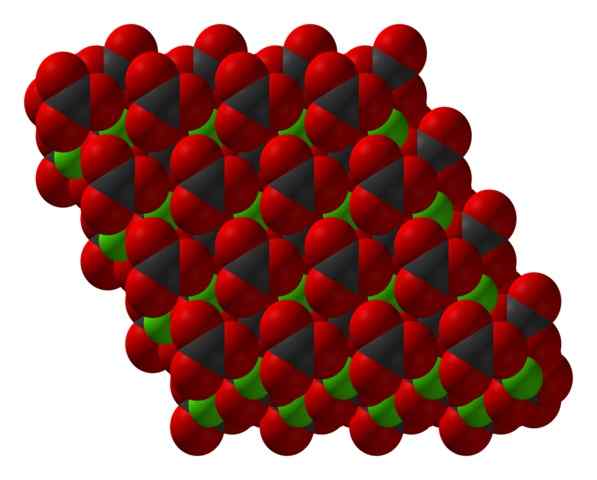 Chanco3 -kiteinen rakenne, jota edustaa avaruustäyttömalli. Lähde: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Chanco3 -kiteinen rakenne, jota edustaa avaruustäyttömalli. Lähde: CCOIL [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Kalsiumkarbonaattikaava, Caco3, osoittaa, että Ca -ionien välinen osuus2+ ja yhteistyökumppani32- Se on 1: 1; eli jokaiselle CA: lle2+ On CO32- vastine, joka on vuorovaikutuksessa sähköisesti hänen kanssaan. Siten ionisidoksella on nämä ionit muodostamaan rakenteellisia kuvioita, jotka määrittelevät kiteen.
Ylemmässä kuvassa Cacon rakenne on esitetty3. Vihreät pallot vastaavat Ca -kationeja2+, ja punaiset ja mustat pallot anioneihin32-. Huomaa, että rakenne näyttää muodostuvan useilla kerroksilla: yksi kalsiumista ja toinen karbonaatista; mikä tarkoittaa, että kiteytyy kompakti kuusikulmainen rakenne.
Se voi palvella sinua: ammoniumkloridi (NH4CL)Tämä kuusikulmainen faasi (β-caco3) Vastaa polymorfia. Muuta on kaksi: ortorrominen (λ-caco3) ja tasaisin tihein kuusikulmainen (μ-caco3-A. Alempi kuva auttaa paremmin visualisoimaan onnellista kuusikulmion:
 Kalsiitin kuusikulmainen rakenne. Materialscientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Kalsiitin kuusikulmainen rakenne. Materialscientist englannissa Wikipediassa [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Lämpötilasta (ja tämän suolan paineen) riippuen ionit niiden värähtelyissä kuitenkin säädetään muihin rakenteisiin; Nämä ovat edellä mainittuja polymorfeja (β, λ ja μ).
Koska ääniä ei ole hyvin, ei tunneta, ellei niitä mainita mineralogisilla nimillään seuraavassa osassa.
Proteiinikovuus
Cacon kiteet3 Ne eivät ole yksin: ne voivat isännöidä epäpuhtauksia kuten muutkin metallikatiot, jotka värjäävät ne väreinä; o Proteiinit, jotka sisältävät orgaanisen matriisin, joka jotenkin myötävaikuttaa sen luonnolliseen kovuuteen.
Proteiinit vähentävät kiteiden kokenut jännitystä ennen painetta tai iskua. Kuten? Kun kiteitä on välissä, toimimalla ikään kuin se olisi "tyyny" (samanlainen kuin tiilisementti-lady).
Siksi tämä yhdiste tai mineraali on biologisesti yhteensopiva, eikä ole yllättynyt siitä, että se on osa kynien, merikuoria, kuoria tai luita. Se on ollut inspiraation lähde niille, jotka ovat omistautuneet uusien materiaalien kehittämiseen.
Ominaisuudet
Muut nimet
-Aragoniitti
-Kalsito
-Volterni
-Kalsiummaito
-Valkotaulu
-Marmori
Moolimassa
100 086 g/mol.
Fyysinen kuvaus
Valkoinen pöly wc.
Maku
Samanlainen kuin liitu, mauton.
Fuusio- ja kiehumispisteet
Se hajoaa, koska se vapauttaa yhteistyökumppanin2 Ennen edes sulamista tai kiehua.
Liukoisuus
Käytännössä liukenematon veteen ja alkoholiin. Se on liuennut poreilemalla laimennettuihin etikkahapoihin. Hydroksidit kuitenkin vähentävät liukoisuuttaan. Samaan aikaan ammoniumsuolat ja hiilidioksidi lisäävät kalsiumkarbonaatin liukoisuutta veteen.
Tiheys
2,7 - 2,95 g/cm3.
Hajoaminen
Noin 825 ºC hajoaa kalsiumoksidiksi (kalkki) ja hiilidioksidiksi (CO2-A.
PHE
8-9
Taitekerroin
-1,7216 - 300 nm ja 1 6584 - 589 nm (kalsita).
-1 5145 - 300 nm ja 1 4864 - 589 nm (aragoniitti).
Yhteensopimattomuudet
Hapolla, alumiinilla ja ammoniumsuoloilla.
Fuusion entalpia
36 kJ/mol 800 ºC: lla (kalsiitti).
Voi palvella sinua: molaarisuus: pitoisuus, yksiköt, laskenta, harjoituksetLiukoisuustuotevakio
3,36 · 10-9 25 ºC: lla.
Kovuus
-3.0 (kalsiitti)
-3,5 - 4,0 (aragoniitti) MOHS -asteikolla.
Vaihesiirto
Aragoniitti on metastabiili ja muuttuu peruuttamattomasti kalsiitiksi, kun se lämmittää sen kuivassa ilmassa 400 ºC: seen.
Reaktiivisuus
Kalsiumkarbonaatti reagoi happojen kanssa vapauttaen hiilidioksidia, ionista kalsiumia ja vettä.
Kalsiumkarbonaatti yhdistetään tyydyttyneeseen veteen hiilidioksidilla, mikä vastaa hiilihappoa (H2Yhteistyö3), Kalsiumbikarbonaatin muodostamiseksi.
Koulutus
Kalkki, marmori ja kalkkikivi, kaksi ensimmäistä mineraalia ja kallioinen materiaali, joka sisältää kolmannen, sisältävät kalsiumkarbonaattia ja ovat sedimenttinen alkuperää.
PH voisi olla tärkein tekijä polymorfien muodostumisessa lämpötilassa 24 ° C. Vaterita on päätuote pH: n välillä 8,5–10; Aragoniitti on pH 11; ja kalsiitti pH: iin> 12.
On myös tiedossa, että monet makean veden levät rakentavat kalsiittikiteitä, kun ne kasvavat kalsiumin kyllästetyssä ympäristössä. Lisäksi mikrolevät kykenevät aiheuttamaan kalsiumkarbonaatin saostumista.
Kalsiumkarbonaattimuodot
Alla olevissa kuvissa kolme päämuotoa tai polymorfia esitetään kalsiumkarbonaatille:
 Kalkkide. Lähde: Vanhempi Géry [julkinen verkkotunnus]
Kalkkide. Lähde: Vanhempi Géry [julkinen verkkotunnus] Aragoniittikide. Lähde: Battistini Riccardo [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Aragoniittikide. Lähde: Battistini Riccardo [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Vatilitakiteet. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Vatilitakiteet. Lähde: Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Ylhäältä alas ovat kalsiitti, aragoniitti- ja vatilita -polymorfit. Huomaa ero niiden kiteiden morfologian välillä (väri on tyypillinen sen alkuperästä ja ympäristöjen ominaisuuksista).
Vaterita on läpinäkymätöntä kuin kalsiitti, jälkimmäisestä tulee tasainen. Sillä välin aragonittikiteitä muistuttavat pieniä pitkänomaisia monoliitteja.
Jos näytteitä näistä kolmesta polymorfista havaitaan elektronisen mikroskoopin alla, niiden kiteitä (harmahtavia sävyjä, koska tekniikka ei salli värien resoluutiota), samat morfologiat löytyvät kuten makroskooppisissa asteikoissa; eli ensi silmäyksellä.
Näistä kolmesta polymorfista kalsiitti on runsain ja vakain, jota seuraa aragoniitti ja lopulta Vaterita, kacon harvinaisin muodoissa3
Voi palvella sinua: Kalorimetria: Mitä tutkimuksia ja sovelluksiaSovellukset
Teollisuuden edustajat
Kalsiumkarbonaatti lisää synteettisen ja luonnonkumin vääntö- ja vetovoiman kestävyyttä ylläpitäen sen joustavuutta. Sitä käytetään rakennusteollisuudessa sementtien ainesosana ja kalkkiraaka -aineena. Sen käyttö on vähentynyt, koska hapan sade vaurioituu.
Kalsiumkarbonaattia käytetään raudanpuhdistuksessa. Kalkin muodossa eliminoi metallissa läsnä olevan rikkidioksidin. Juurikkaiden sokeripuhdistusta käytetään. Sitä käytettiin liuton liiduna, mutta se on korvattu tämän sovelluksen kipsillä.
Kalsiumkarbonaatti sekoitetaan lasin sijoittamiseen käytetyn kitin kanssa. Maata käytetään täyttömateriaalina vaipoissa käytetyn mikrohuokoisessa kalvossa. Sitä käytetään myös täyttömateriaalina muoveissa, kuten PVC. Lisäksi muovin lujuus kasvaa.
Kalsiumkarbonaattia käytetään lisäämään maalausten kattavuuskapasiteettia. Sitä käytetään paperin täyttömateriaalina, koska se on halvempi kuin puukuitu, joka pystyy edustamaan yli 10% paperista.
Lääkärit
Sitä käytetään antasidina mahalaukun hyperaktiivisuuden torjumiseksi ja ruoansulatushäiriöiden lievittämiseksi. Sitä käytetään ruokavalion kalsiumlisinä ja osteoporoosin hoidossa ja ehkäisyssä. Sitä käytetään hyperfosfatian hoidossa potilailla, joilla on krooninen munuaisten vajaatoiminta.
Sitä on käytetty vähentämään HIV: n hoidossa käytettyjen proteaasi -inhibiittorien ei -toivottuja vaikutuksia, tarkkailemalla potilailla ripulin vähenemistä.
Se aiheuttaa verenpaineen laskua raskaana olevilla naisilla, joilla on verenpainetauti ja preeklampsia.
Toiset
Kalsiumkarbonaattia käytetään maataloudessa lannoitteena ja maaperän happamuuden torjumiseksi. Sitä käytetään säilöntäaineena, värien pidättäjänä ja vahvistaa ruokaa.
Lisäksi se on hammastahnan ainesosa, ja se toimii hiomina pölyssä puhdistuksessa ja pesussa.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Karbonaattikalsium. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2019). Karbonaattikalsium. Pubchem -tietokanta., CID = 10112. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Kai-Yin Chong, Chin-Hua Chia ja Sarani Zakaria. (2014). Polymorfit kalsiumkarbonaatti lämpötilareaktiossa. AIP -konferenssin julkaisut 1614, 52; doi.org/10.1063/1.4895169
- Greg Watry. (1. marraskuuta 2016). Howum -karbonaattikiteiden löytäminen saa lujuutta. Etu liiketoimintamarkkinointi. Toipunut: rdmag.com
- Amerikkalaiset elementit. (2019). Karbonaattikalsium. Haettu: Amerikkalaiset.com
- Elsevier. (2019). Karbonaattikalsium. Tiede. Haettu: ScienEdirect.com
- Kemiallinen kirja. (2017). Karbonaattikalsium. Palautettu: Chemicalbook.com

