Kaliumkarbonaattikarbonaattirakenne (K2CO3) rakenne, ominaisuudet, käyttää, hankkimalla

- 3788
- 657
- Louis Moen
Hän Kaliumkarbonaatti Se on epäorgaaninen yhdiste, joka on muodostunut kahdella kaliumionilla K+ ja hiili -ion co32-. Sen kemiallinen kaava on k2Yhteistyö3. Se on hygroskooppinen valkoinen kiinteä aine, ts. Se imee veden helposti ympäristöstä. Siksi laboratorioissa sitä käytetään veden absorboimiseen muista aineista.
Se on hyvin liukoinen veteen muodostaen emäksisiä liuoksia, joissa on runsaasti OH -ioneja-ja siksi korkealla pH -arvolla. Sen vesiliuoksia, koska ne ovat emäksisiä, käytetään useissa teollisuusprosesseissa happokaasujen, kuten hiilidioksidin, absorboimiseksi2 ja rikkivety H2S, sitten neutraloi ne helposti.
 Kaliumkarbonaatti k2Yhteistyö3 kiinteä. Ondřej Mangl [julkinen alue]. Lähde: Wikimedia Commons.
Kaliumkarbonaatti k2Yhteistyö3 kiinteä. Ondřej Mangl [julkinen alue]. Lähde: Wikimedia Commons. K2Yhteistyö3 Sitä käytetään saippuat, puhdistusaineiden, pesuaineiden valmistukseen vaatteiden ja seosten pesemiseen astioiden pesemiseksi. Sitä käytetään myös joidenkin tekstiilikuitujen, kuten villan, käsittelyssä.
Sitä käytetään laajasti kemian laboratorioissa, esimerkiksi veden absorboimiseksi muista yhdisteistä tai kemiallisten reaktioiden seoksista ja myös kemiallisessa analyysissä.
Sitä lisätään myös joihinkin elintarvikkeisiin, esimerkiksi kaakaonsiementen katkeran maun poistamiseksi suklaantuotannon aikana.
[TOC]
Rakenne
Kaliumkarbonaatti koostuu kahdesta kaliumkekatista+ ja karbonaatti -anionin Co32-. Karbonaatti -anionilla on tasainen ja symmetrinen rakenne, kun taas kolme happiatomia ympäröi hiiltä muodostaen tasaisen kolmion.
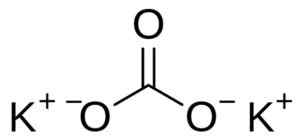 Kaliumkarbonaattirakenne k2Yhteistyö3. Käyttäjä: Edgar181 [julkinen verkkotunnus]. Lähde: Wikimedia Commons.
Kaliumkarbonaattirakenne k2Yhteistyö3. Käyttäjä: Edgar181 [julkinen verkkotunnus]. Lähde: Wikimedia Commons. Nimikkeistö
- Kaliumkarbonaatti
- Kaliumkarbonaatti
- Dipotasiumkarbonaatti
- Potas
- Hiilihappokaliumsuola.
Ominaisuudet
Fyysinen tila
Kiteinen yksiväritön tai valkoinen.
Molekyylipaino
138 205 g/mol.
Sulamispiste
899 ºC.
Kiehumispiste
Se hajoaa.
Tiheys
2,29 g/cm3
Liukoisuus
Hyvin liukoinen veteen: 111 g/100 g vettä 25 ° C: ssa. Liukenematon etanoliin ja asetoniin.
Voi palvella sinua: Kemian panokset lääketieteellePHE
Vesipitoisella liuoksella voi olla pH 11,6, ts. Se on melko emäksinen.
Kemialliset ominaisuudet
Kaliumkarbonaatti on herkkua tai hygroskooppista, ts. Se imee ympäristön kosteutta. Siinä on vakaa hydraatti, k2Yhteistyö3.2H2JOMPIKUMPI.
K2Yhteistyö3 Vesipitoisessa liuoksessa se on hydrolysoitu, ts. Se reagoi veden kanssa vapauttamalla OH -ryhmät- jotka ovat ne, jotka antavat alkalisuuden ratkaisuille:
Yhteistyö32- + H2Tai ⇔ Voi- + HCO3-
HCO3- + H2Tai ⇔ Voi- + H2Yhteistyö3
Saada
Voidaan saada jäljellä olevista tuhkasta polttaessa kasveja. Myös KOH -kaliumhydroksidin hiilihapolla, ts. Ylimääräisen hiilidioksidin Co: n lisääminen2 KOH: lle:
Koh + Co2 → khco3
2 khco3 + Lämpö → K2Yhteistyö3 + H2JOMPIKUMPI
Toinen tapa saada se on Kcl -kaliumkloridin lämmittäminen magnesiumkarbonaatilla3, vesi ja yhteistyökumppani2 paineen alla. Ensin saadaan kaksinkertainen hydratoitu magnesium ja kaliumsuola ja kalium3.Khco3.4H2Tai, nimeltään Engels Salt:
2 kcl + 3 mgco3 + Yhteistyö2 + 5 h2O → MGCO3.Khco3.4H2Tai ↓ + mgcl2
Engelsien kaksois hydratoitu suola saostuu ja erottuu liuoksesta suodattamalla. Sitten kalium -autokarbonaatti lämmitetään ja muodostetaan2Yhteistyö3 että lisäämällä vettä liukenee, kun Mgco Magnesium -karbonaatti3 pysyy liukenemattomana ja eliminoituu suodatuksella.
Mgco3.Khco3.4H2O + lämpö → mgco3↓ + 2 K+ + Yhteistyö32- + Yhteistyö2↑ + 9 h2JOMPIKUMPI
Sovellukset
CO: n imeytymisessä2 Teollisuusprosesseissa
Kaliumkarbonaattiliuos on klassinen käsittely hiilidioksidin poisto -CO: lle2 Eri prosesseissa, etenkin korkeissa paineissa ja lämpötilan sovelluksissa.
 K -ratkaisut2Yhteistyö3 Niitä käytetään absorbointiin CO2 Erilaisissa teollisuusprosesseissa. Kirjoittaja: Nicola Giordano. Lähde: Pixabay.
K -ratkaisut2Yhteistyö3 Niitä käytetään absorbointiin CO2 Erilaisissa teollisuusprosesseissa. Kirjoittaja: Nicola Giordano. Lähde: Pixabay. CO: n poistaminen2 tapahtuu seuraavan reaktion mukaan:
K -k -2Yhteistyö3 + Yhteistyö2 + H2Tai ⇔ 2 khco3
Tätä menetelmää käytetään esimerkiksi maakaasun hoitoon. Myös energiantuotantolaitoksissa CO: n päästöjen välttämiseksi2 ilmakehään ja kuivan jään tuotannossa.
Voi palvella sinua: kuparihydroksidi (II): rakenne, ominaisuudet, nimikkeistö, käyttö K -ratkaisut2Yhteistyö3 Niitä käytetään CO: n hankkimiseen2 joka tekee kuivaa jäätä. Projectmanhattan [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons.
K -ratkaisut2Yhteistyö3 Niitä käytetään CO: n hankkimiseen2 joka tekee kuivaa jäätä. Projectmanhattan [CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)]. Lähde: Wikimedia Commons. K -liuotus2Yhteistyö3 Se voidaan uudistaa lämpöä, ts.
Jotta kaliumkarbonaattiliuos absorboi hiilidioksidia hyvällä nopeudella, lisätään promoottoreita, jotka nopeuttavat prosessia, kuten dioneloliamiini (DEA).
H: n poistossa2Tiettyjä prosesseja
Kaliumkarbonaattiliuoksia käytetään myös rikkivetykaasun h poistamiseen2Prosessivirrat. Joskus lisätään kalium -tiffosfaatti k3Poikki4 Prosessin nopeammin.
Kemian laboratorioissa
K2Yhteistyö3 sallii orgaanisen synteesin esimerkiksi kondensaatioreaktioissa ja neutraloida. Sen tarkoituksena on poistaa vettä orgaanisista nesteistä, kuivaus- tai kuivausaineena laboratoriossa.
Sitä käytetään myös analyyttisissä kemiareaktioissa ja alkalisoinnissa lääketeollisuudessa.
Siivoustuoteteollisuudessa
K2Yhteistyö3 Sitä käytetään saippuan valmistukseen, kaavojen puhdistamiseen, astioiden vaatteiden ja muiden henkilökohtaisten hygienian tuotteiden valmistukseen ja myös muiden henkilökohtaisten hygieniatuotteiden valmistukseen.
 K2Yhteistyö3 Sitä käytetään saippuavalmistuksessa. Lacrosus [julkinen alue]. Lähde: Wikimedia Commons.
K2Yhteistyö3 Sitä käytetään saippuavalmistuksessa. Lacrosus [julkinen alue]. Lähde: Wikimedia Commons. Elintarviketeollisuudessa
Kaliumkarbonaattia lisätään useisiin elintarvikkeisiin useiden tarkoituksiin.
Esimerkiksi se lisätään kaakaonsiemeniin katkeran maun poistamiseksi ja niiden käyttämiseksi suklaantuotannossa. Se lisätään kuivausprosessin viinirypäleisiin rypäleiden saamiseksi.
 Kaakaon siemenet hoidetaan k: lla2Yhteistyö3 Vähentää sen katkeraa makua suklaan valmistettaessa. Kirjailija: Magali Couret. Lähde: Pixabay.
Kaakaon siemenet hoidetaan k: lla2Yhteistyö3 Vähentää sen katkeraa makua suklaan valmistettaessa. Kirjailija: Magali Couret. Lähde: Pixabay. Leivonnaiskaupassa sitä käytetään jauhojen leudanttina (hiivana) paistettujen ruokien valmistamiseksi.
Voi palvella sinua: lutecio: rakenne, ominaisuudet, käyttötarkoitukset, hankkiminen K2Yhteistyö3 Sitä voidaan käyttää kakkujen linnaksi, koska kun se antaa CO: n2 Keittämisen aikana nämä lisäävät tilavuutta. Kirjoittaja: Pixel1. Lähde: Pixabay.com
K2Yhteistyö3 Sitä voidaan käyttää kakkujen linnaksi, koska kun se antaa CO: n2 Keittämisen aikana nämä lisäävät tilavuutta. Kirjoittaja: Pixel1. Lähde: Pixabay.com Lannoitteissa
K2Yhteistyö3 Sitä käytetään happojen maaperän hedelmöittämiseen, kuten hiili -ionin Co32- Kosketuksessa veden kanssa tuottaa OH -ioneja- Se lisää maan pH: ta. Kaliumk -k: n lisäksi+ Se on kasvien ravintoaine.
Kaliumkarbonaattia on käytetty myös hitaasti lannoitteiden tekemiseen.
Hitaasti vapaata lannoitteet vapautuvat tai löysät ravintoaineet niin, että niitä ei liuennut ja vettä vettä. Tämän ansiosta he voivat viettää enemmän aikaa kasvien juurille.
Useissa sovelluksissa
Kaliumkarbonaatti k2Yhteistyö3 Sitä käytetään myös:
- Kuivaus, valkaistu ja puhdas villapuhdistusprosessit ja muut tekstiiliteollisuustoiminnot
- Muiden orgaanisten ja epäorgaanisten kaliumsuolojen, kuten KCN -kaliumsyanidin, hankkiminen.
- Toiminta happamuuden säätelijänä erilaisissa prosesseissa.
- Tehdä keraamista ja keramiikkaa.
- Kaiverrus- ja litografiaprosessit.
- Rusketus.
- Valmista tulostettuja musteita, pigmenttejä.
- Lasi2Yhteistyö3 Se on yhteensopivampi kuin natriumkarbonaatti Na2Yhteistyö3 Lyijyn, bariumin ja strontiumoksidien kanssa, jotka nämä lasit sisältävät.
- Vedenkäsittely.
- Viivästytä tulipalo (vesiliuoksina).
- Estää korroosiota ja prosessiryhmissä.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Kaliumkarbonaatti. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Steele, D. (1966). Metallielementtien kemia. Pergamon Press Ltd. Lontoo.
- Mokhatab, s. et al. (2019). Maakaasukäsittely. Kaliumkarbonaattiliuos. Maakaasun siirron ja prosessoinnin käsikirjassa (neljäs painos). ScienEdirect.com.
- Kakaras, E. et al. (2012). Paineistettu fluidisoitu sängyn palamis (PFBC) yhdistetyt syklijärjestelmät. Paineistettu fluidoitu sängyn palaminen hiilen sieppauksella ja varastoinnilla. Yhdistetyissä syklijärjestelmissä lähes nollapäästöjen voimantuotantoon. ScienEdirect.com.
- Speight, J.G. (2019). Vetytuotanto. Märkä pesua. Raskaan öljyn talteenotto ja päivitys. ScienEdirect.com.
- Branan, c.R -. (2005). Kaasukäsittely: Chris Higmanin päivittämä luku. Kuuma karbonaattiprosessi. Kemian insinöörien peukalosäännöissä (neljäs painos). ScienEdirect.com.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Neljäs painos. John Wiley & Sons.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Vch verlagsgellschaft mbh.
- Li, ja. ja Cheng, f. (2016). Uuden hitaasti vapautuvan kaliumlannoitteen synteesi modifioidusta Pidgeon-magnesiumkuonasta kaliumkarbonaatilla. J Air Waste Manag Assoc, 2016 elokuu; 66 (8): 758-67. NCBI toipunut.Nlm.NIH.Hallitus.

