Sinkkikarbonaatti (ZnCO3) rakenne, ominaisuudet, käytöt

- 4729
- 514
- Eddie Hackett
Hän sinkkikarbonaatti Se on epäorgaaninen yhdiste, jonka muodostaa sinkki (Zn), hiili (C) ja happi (O) -elementit (O). Sen kemiallinen kaava on Znco3. Sinkin hapetustila on +2, hiili +4 ja happi -2.
Se on väritön tai valkoinen.
 Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.com-cc-by-sa-3.0/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons.
Smithsonita, Znco Mineral3. Rob Lavinsky, Irocks.com-cc-by-sa-3.0/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons. Znco3 Se on melkein liukenematon veteen, mutta se on helposti liuennut laimennettuihin happoihin, koska karbonaatti -ioni happamassa hibononisessa muodossa (H2Yhteistyö3), josta tulee sitten CO -kaasu2 ja vettä.
Sitä käytetään antiseptisenä eläinhaavoissa ja se toimitetaan joskus ruokavaliossa sinkin puutteen aiheuttamien sairauksien välttämiseksi.
Se viivästyy palanut, että tietyt kuidut, muovit ja ikenet ovat yhteydessä tuleen. Mahdollistaa myrkyllisten arseenimineraalien erottamisen muista kivistä turvallisesti.
Sitä on käytetty dentifric -pasteissa dentinin palauttamiseksi hampaissa valkaisun alla.
[TOC]
Rakenne
Znco3 Se muodostuu Zn -kationista2+ ja Anion Co32-. Hiilen karbonaatti -ionissa on hapettumistila +4. Tällä ionilla on tasainen rakenne, ja hiiliatomia ympäröivät kolme happiatomia.
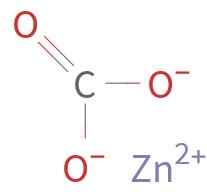 Sinkkikarbonaatin kemiallinen rakenne. Tuntematon kirjailija / julkinen verkkotunnus. Lähde: Wikimedia Commons.
Sinkkikarbonaatin kemiallinen rakenne. Tuntematon kirjailija / julkinen verkkotunnus. Lähde: Wikimedia Commons. Nimikkeistö
- Sinkkikarbonaatti
- Sinkkimonokarbonaatti
- Hiilihappo sinkkisuola
- Smithsonita
- Sinkki -sytytys
Ominaisuudet
Fyysinen tila
Väritön kiinteä tai kiteinen valkoinen. Rombiat kiteet.
 Sinkkikarbonaatti. Ondřej Mangl / Pub -verkkotunnus. Lähde: Wikimedia Commons.
Sinkkikarbonaatti. Ondřej Mangl / Pub -verkkotunnus. Lähde: Wikimedia Commons. Molekyylipaino
125,4 g/mol
Sulamispiste
140 ºC: n kohdalla se hajoaa ilman sulamista.
Tiheys
4 398 g/cm3 20 ° C: ssa.
Liukoisuus
Käytännössä liukenematon veteen: 0,000091 g/100 g h2Tai 20 ° C: ssa. Liukoinen laimennettuihin hapoihin, alkaliin ja ammoniumsuoloihin. Liukenematon ammoniakkiin, alkoholiin ja asetoniin.
Kemialliset ominaisuudet
Reagoi hiilidioksidin muodostavien happojen kanssa:
Znco3 + 2 h+ → Zn2+ + H2Tai + Co2↑
Se liukenee hydroksidin muodostaviin emäksiin, mikä on osittain liuennut sinkato -ionin:
Voi palvella sinua: Bromi: Historia, rakenne, elektroninen kokoonpano, ominaisuudet, käyttöZnco3 + 2 OH- → Zn (OH)2 + Yhteistyö32-
Zn (OH)2 + H2Tai + OH- → [Zn (OH)3(H2JOMPIKUMPI)]-
Se ei ole syttyvä. Kun se on kuumentunut hajoamiseen.
Znco3 + Lämpö → ZnO + Co2↑
Saada
Smithsonite -mineraali saadaan, aiemmin kutsutaan sinkin spatiksi.
Se voidaan valmistaa myös sekoittamalla natriumkarbonaattiliuos sinkkisuolalla, kuten sinkkisulfaatti. Natriumsulfaatti pysyy liuenneena ja sinkkikarbonaatti saostuu:
Znso4 + Naa2Yhteistyö3 → Znco3↓ + NA2Sw4
Sovellukset
Lääketieteellisissä hoidoissa
Tämän yhdisteen avulla voit hankkia joitain lääketuotteita. Se levitetään tulehtuneeseen ihoon pölyn tai voiteen muodossa.
Eläinlääketieteellisissä sovelluksissa
Znco3 Se toimii eläinten eläinten supistavana, antiseptisenä ja ajankohtaisena suojelijana.
Se sallii myös sinkin puutteen aiheuttamien sairauksien estämisen, joten sitä käytetään joidenkin eläinten ruokavalion lisäravinteena edellyttäen, että annetut määrät ovat terveysvirastojen perustamien normien sisällä.
 Sinkkikarbonaatti annetaan joskus mikrotravinteina sikojen sairauksien välttämiseksi. Tuntematon kirjailija / CC0. Lähde: Wikimedia Commons.
Sinkkikarbonaatti annetaan joskus mikrotravinteina sikojen sairauksien välttämiseksi. Tuntematon kirjailija / CC0. Lähde: Wikimedia Commons. Porcheratoosin puhkeamisissa sikoissa se lisätään näiden ruokavalioon. Tämä tauti on ihon muutos, jossa sarveiskalvon kerros ei ole kunnolla muodostettu.
Liekin hidastimena
Sitä käytetään kumin ja muovien palonkestävänä täyteinä, jotka altistuvat korkeille lämpötiloille. Antaa sinun suojata tekstiilikuituja tulipalolta.
Puuvillatekstiilien tapauksessa se levitetään kankaaseen yhdessä alkalin kanssa. Tämä hyökkää suoraan primaarisia hydroksyyliryhmiä (-CH2OH) selluloosasta ja tekee niistä sodioselluloosaa (-CH2Ona).
Selluloosayhteyksien repeämä alkalilla suosii kompaktin selluloosirakenteen ketjujen suurempaa tunkeutuvuutta, niin että enemmän ZnCO -määrää3 onnistuu pääsemään tämän amorfiseen vyöhykkeeseen ja sen leviämistä helpotetaan.
Voi palvella sinua: Vanadiumi: Historia, ominaisuudet, rakenne, käyttötarkoitukset Jotkut puuvillakankaat voivat sisältää Zncoa3 heidän kuiduissaan tehdä heistä kestäviä tulipaloon. Socken_farbig.JPEG: Scott Bauererivatiivityö: sukka / julkinen verkkotunnus. Lähde: Wikimedia Commons.
Jotkut puuvillakankaat voivat sisältää Zncoa3 heidän kuiduissaan tehdä heistä kestäviä tulipaloon. Socken_farbig.JPEG: Scott Bauererivatiivityö: sukka / julkinen verkkotunnus. Lähde: Wikimedia Commons. Tämän seurauksena tulipalon kanssa tapahtuvan syttyvän kaasun määrä vähenee.
Hammashoitoissa
Tietyt sinkkikarbonaattikiteisiin ja hydroksiapatiittiin perustuvat hammasproteesit ja hydroksyapatiittiin perustuvat hammasproteesit vähentävät yliherkkyyttä tehokkaammin kuin fluoridiin perustuvat.
Zncon nanokiteet3 ja hydroksiapatiitissa on koko, muoto, kemiallinen koostumus ja kiteisyys, joka.
 Znco -nanohiukkaset3-Hydroksiapathite on testattu onnistuneesti valkaistujen hampaiden herkkyyden vähentämiseksi. Kirjoittaja: Photo Mix. Lähde: Pixabay.
Znco -nanohiukkaset3-Hydroksiapathite on testattu onnistuneesti valkaistujen hampaiden herkkyyden vähentämiseksi. Kirjoittaja: Photo Mix. Lähde: Pixabay. Tämäntyyppiset dentifric -paskit olivat hyödyllisiä hammasvalkaisuprosessien jälkeen.
Vaarallisten arseenimineraalien erottamiseksi
Rikkikivien arseeni mineraalimenetelmät (kuten galena, kalkopyriitti ja pyriitti) on testattu ZNCO: n avulla)3. Arseenin malmi on erotettava muista, koska tämä elementti on erittäin myrkyllinen ja myrkyllinen epäpuhtaus eläville olentoille.
Tämän saavuttamiseksi maadoituskivien seos käsitellään sinkkisulfaattiliuoksella ja natriumkarbonaatilla pH: lle 7,5-9,0 ja ksantaattiyhdisteelle.
 Arsenopirita. Tämä mineraali tulisi erottaa muista, koska se sisältää arseenimyrkyllisiä. Erottelu voidaan saavuttaa sinkkikarbonaatilla. James St. John/CC by (https: // creativecommons.Org/lisenssit/by/2.0). Lähde: Wikimedia Commons.
Arsenopirita. Tämä mineraali tulisi erottaa muista, koska se sisältää arseenimyrkyllisiä. Erottelu voidaan saavuttaa sinkkikarbonaatilla. James St. John/CC by (https: // creativecommons.Org/lisenssit/by/2.0). Lähde: Wikimedia Commons. Kaavan tehokkuus johtuu pienten Znco -hiukkasten muodostumisesta3 Arsenopyriitin pinnalla tekee siitä hydrofiilisen (liittyy veteen), joten et voi tarttua ilmakuplia etkä voi kellua, saostaen ja erottamalla muista mineraaleista.
Muiden sinkkiyhdisteiden saamisessa
Sinkkikarbonaattia on käytetty saamaan hydrofobiset nanorakenteet Formula 3zno • 3b2JOMPIKUMPI3• 3,5h2JOMPIKUMPI. Tätä materiaalia voidaan käyttää liekinestoaineena lisäaineena polymeereissä, puussa ja tekstiileissä.
Jäännösteosien sinkin palautumisessa
Elektrodipositioprosessien hylätyt sinkki -ionien rikkaat synteettiset vedet voidaan käsitellä fluidisoitua sänkytekniikkaa natriumkarbonaattia käyttämällä ZnCO: n saostamiseen3.
Voi palvella sinua: Toissijainen alkoholi: Mikä on, rakenne, ominaisuudet, käyttötarkoituksetKun Zn saostuu2+ Karbonaatin muodossa vähenee sen pitoisuutta, saadut kiinteät kiinteät kiinteät kiinteät ja vedet voidaan hylätä turvallisesti. Znco3 Sakka on korkea puhtaus.
Muut sovellukset
Mahdollistaa muiden sinkkiyhdisteiden valmistelun. Sitä käytetään kosmetiikassa. Se toimii pigmenttinä ja sitä käytetään posliinin, keramiikan ja keramiikan valmistuksessa.
Riskejä
Znco -pölyn hengitys3 Se voi aiheuttaa hallintaa, yskää, rinta-, kuumetta ja hikoilua. Sen nauttiminen tuottaa pahoinvointia ja oksentelua.
Vaikutukset ympäristöön
Tärkein riski on sen vaikutus ympäristöön, joten sitä tulisi välttää hajallaan tässä. Se on hyvin myrkyllistä vesielämälle seurauksilla, jotka viimeksi elävät organismit.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Sinkkikarbonaatti. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Sharma, V. et al. (2018). Sinkkikarbonaatti -nanoneeklien synteesi potentiaaliseen liekin hidastimeen puuvillatekstiileille. Selluloosa 25, 6191-6205 (2018). Linkki palautettu.Jousto.com.
- Guan, ja. et al. (2020). Kolloidinen Znco3 voimakkaana arsenopyriitin masennusaineena heikosti alkalisissa massassa ja vuorovaikutusmekanismissa. Mineraalit 2020, 10, 315. MDPI toipui.com.
- Ihon, silmän, sidekalvon ja ulkoisen korvan sairaudet. (2017). Eläinlääketieteessä (yhdestoista painos). ScienEdirect.com.
- Hannig, m. ja Hannig, c. (2013). Nanobiomateriaalit ennaltaehkäisevässä hammaslääketieteessä. Nanobiomateriaalissa kliinisessä hammaslääketieteessä. Luku 8. ScienEdirect.com.
- Tugrul, n. et al. (2015). Hydrofobisten nanorakenteiden synteesi sinkkiharja sinkkikarbonaatista ja tuotteen karakterisointi. Res Chem Intermediate (2015) 41: 4395-4403. Linkki palautettu.Jousto.com.
- Luna, m.D -d.G., et al. (2020). Sinkkrakeiden talteenotto synteettisistä sähköpuhdistuksista jätevesillä käyttämällä fluidisoitua kitetistä homogeenista kiteyttämisprosessia. Int. J -. Ympäristö. Sci. Tekniikka. 17, 129-142 (2020). Linkki palautettu.Jousto.com.

