Hiili 12 ydinmerkinnät, historia, kommentit
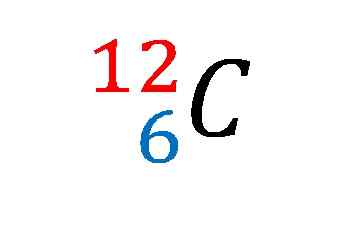
- 4585
- 1035
- Shawn Stanton II
Hän Hiili-12 Se on hiilielementin runsain isotooppi, jossa on 98,93%: n runsaasti. Lisäksi se on tärkein vastuussa kaikista hiili -elementille annetuista ominaisuuksista ja sovelluksista.
Hän 12C Atomisimassa, joka on tarkalleen 12 daltonia, se toimii viitteenä muiden nukleidien atomimassojen muodostamiselle. Atomi 12C koostuu kuudesta protoneista, neutronista ja elektroneista; Elektronien massaa pidetään kuitenkin vähäpätöisinä.
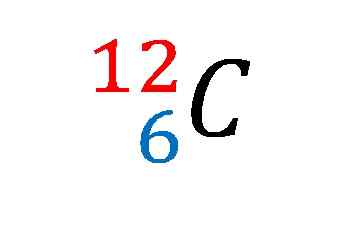 Ydinmerkinnät hiili-isotooppi-12: lle. Lähde: Gabriel Bolívar
Ydinmerkinnät hiili-isotooppi-12: lle. Lähde: Gabriel Bolívar Elementeissä on yleensä atomimassoja, jotka ilmaistaan kokonaismäärinä, joita seuraa desimaalit, koska elementeillä voi olla useita vakaita isotooppeja.
Siksi elementtien atomimassat ilmaistaan niiden erilaisten isotooppien atomisimien painotettuna keskiarvona. Ottaen huomioon, että 12C: n runsaasti on 98,93%ja 13C Hiilen atomimassa on 1,15%runsaus 12 011 Dalton.
Elementin atomimassa ilmaistaan sen eri atomien atomimassajen keskiarvona suhteessa kahdentoista osan massan kanssa 12C, joka tunnetaan yhtenäisenä atomismassan yksikönä; Aikaisemmin lyhennetty nimellä "Uma" ja tällä hetkellä "u".
[TOC]
Ydinmerkinnät
Yläkuvassa osoitettiin hiili-12-isotooppin ydinmerkinnät tai symboli.
Kuvaileva on sama kuin hiiliatomin ominaispiirteiden istuminen. Sen atominumero 6 osoittaa sen ytimessä olevien protonien lukumäärän. Numero 12 on yhtä suuri kuin protonien ja neutronien summa, ja siksi kyse on atomimassasta; joka on verrannollinen ydinmassaan.
Voi palvella sinua: rautaoksidiJa vaikka tämä merkintä ei osoita sitä, on 6 elektronia, jotka estävät ytimen protonien positiivista kuormaa. Kemiallisten sidosten kannalta neljä näistä kuudesta elektronista on ne, jotka muodostavat elämän perustan sellaisena kuin me sen tiedämme.
Historia
Daltonin tutkimukset (1810) huomauttivat, että vesi sisälsi happiprosentin 87,7% ja 12,5% vety. Mutta Dalton sanoi, että vesikaava oli OH. Davy ja Berzelius (1812) korjasivat vesikaavan h2JOMPIKUMPI.
Myöhemmin Berzelius löysi seuraavan veden koostumuksen: happi 88,8% ja vety 11,2%. Hän katsoi, että vedyn atomipaino on 1 g ja 16 g: n happi.
Sitten he tajusivat, että käyttämällä 1 g: n atomipainoa vedyssä hapen atomipaino olisi 15,9 g. Tästä syystä muun muassa 16 g happea atomimassan määrittäminen eri kemiallisten elementtien atomisimassaan vertailustandardiksi.
Happea käytettiin referenssikuviona 1800 -luvun lopusta vuoteen 1961, jolloin päätettiin käyttää hiiltä vertailustandardina eri elementtien atomimaisten muodostamiseksi.
Ennen vuotta 1959 IUPAP ja IUPAC käyttivät happielementtiä MOL: n määrittelemiseen seuraavalla tavalla: 1 mol on 16 g.
Yleiset kommentit
Puhua jstk 12C viittaa hiileen kokonaisuutena; tai ainakin 98% sen olemuksesta, mikä riittää tällaiseen lähentämiseen. Siksi tästä isotoopeista puuttuu käyttö itsessään, kun taas elementti ja kiinteät aineet, jotka integroivat satoja sovelluksia.
Voi palvella sinua: arvostetut ratkaisutOn kuitenkin huomattava, että elävilla organismeilla on erityinen mieltymys tähän isotooppiin 13C; eli prosenttiosuus 13C tai suhde 12C/13C vaihtelee ekosysteemeistä, alueista tai eläinlajeista.
Tämä voi johtua siitä, että molekyylit, joissa on liian monta atomia 13C, raskaampi, haittaa tai vahingoittaa metabolisia prosesseja ja kehon solujen toimintaa; Vaikka prosenttiosuus 13C elävissä olennoissa se oli hiukan korkeampi kuin 1%.
Siksi 12C on elämästä vastuussa olevan hiilen isotooppi. Ja 14C sen jäännöksen "aikomittari" radioaktiivisen rappeutumisensa ansiosta.
Toinen epäsuora hyödyllisyys 12C on luoda ”kontrasti” ydinmagneettikesonanssispektroskopiatekniikalle 13C, jonka kanssa orgaanisten yhdisteiden hiilihapotettu rakenne voidaan selvittää (löydä ja rakentaa).
Viitteet
- Phillips, basilika. (8. heinäkuuta 2019). Mikä on hiilen yleinen isotooppi? Tiede.com. Toipunut: tiedekunnasta.com
- César Tomé López. (2019). Atomipainot. Haettu: Culturacientifica.com
- Elsevier. (2019). Hiili-12. Tiede. Haettu: ScienEdirect.com
- R -. alus. (S.F.-A. Ydinmerkinnät. Toipunut: Hyperfysiikka.Phy-Astr.GSU.Edu
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- « Karbonyyliryhmän ominaisuudet, ominaisuudet, nimikkeistö, reaktiivisuus
- Heriberto Frías Biography, tyyli, toimii »

