Kalsiumkarbidi (CAC2) rakenne, ominaisuudet, hankkiminen, käyttö

- 1256
- 121
- Sheldon Kuhn
Hän Kalsiumkarbidi Se on epäorgaaninen yhdiste, joka on muodostanut kalsiumin (CA) ja hiili (c) elementit (c). Sen kemiallinen kaava on CAC2. Se on kiinteä, joka voi olla väritöntä kellertävän tai harmahtavan valkoisen ja jopa mustan sen sisältämistä epäpuhtauksista riippuen.
Yksi hänen tärkeimmistä CAC: n kemiallisista reaktioista2 on se, joka tapahtuu vedellä H2Tai jossa hc irti asetyleenimuoto. Siksi sitä käytetään asetyleenia teollisesti. Samasta vesireaktiosta käytetään hedelmien kypsiin, väärennettyihin tykkeihin ja merivoimiin.
 CAC -kalsiumkarbidi2 kiinteä. Ondřej Mangl / Pub -verkkotunnus. Lähde: Wikimedia Commons.
CAC -kalsiumkarbidi2 kiinteä. Ondřej Mangl / Pub -verkkotunnus. Lähde: Wikimedia Commons. CAC: n reaktio2 Veden kanssa tuottaa myös hyödyllisen mudan klinkkerin (sementtikomponentin) valmistamiseksi, joka tuottaa vähemmän hiilidioksidia (CO2) Verrattuna perinteiseen sementin tuotantomenetelmään.
Typen kanssa (n2) Kalsiumkarbidi muodostaa kalsiumin syanamidia, jota käytetään lannoitteena. CAC2 Sitä käytetään myös rikin poistamiseen tietyistä metalliseoksista.
Jonkin aikaa sitten CAC2 Sitä käytettiin SO: n nimellisissä karbidilamppuissa, mutta nämä eivät ole enää kovin yleisiä, koska ne ovat vaarallisia.
[TOC]
Rakenne
Kalsiumkarbidi on ioninen yhdiste, ja se muodostuu CA -kalsio -ionilla2+ ja karbidi tai asetyyluro C22-. Karbidi -ioni koostuu kahdesta hiiliatomista, jotka yhdistyvät kolminkertaisella sidoksella.
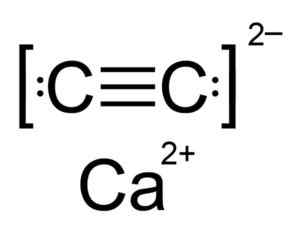 Kalsiumkarbidin kemiallinen rakenne. Kirjoittaja: Hellbus. Lähde: Wikimedia Commons.
Kalsiumkarbidin kemiallinen rakenne. Kirjoittaja: Hellbus. Lähde: Wikimedia Commons. CAC: n kiteinen rakenne2 Se on johdettu kuutiosta (kuten natriumkloridi NaCl), mutta kuten ioni C22- Rakenne on pitkänomainen vääristynyt ja kääntyy tetragonaaliksi.
Nimikkeistö
- Kalsiumkarbidi
- Kalsiumkarbidi
- Kalsiumiasetyyli
Ominaisuudet
Fyysinen tila
Kiteinen.
 CAC -kalsiumkarbidi2 Epäpuhtauksilla. Leiem/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
CAC -kalsiumkarbidi2 Epäpuhtauksilla. Leiem/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Molekyylipaino
64 0992 g/mol
Se voi palvella sinua: AliLo: Allyic Unit, Carbocation, Radical, EsimerkitSulamispiste
2160 ºC
Kiehumispiste
CAC2 kiehuu 2300 ºC: n nopeudella hajoamisella. Kiehumispiste tulisi mitata inertissä ilmakehässä, ts. Ilman happea tai kosteutta.
Tiheys
2,22 g/cm3
Kemialliset ominaisuudet
Kalsiumkarbidi reagoi veden kanssa hcpear -asetyleenin ja CA -kalsiumhydroksidin (OH) muodostamiseksi2-
Cac2 + 2 h2O → HC≡CH + CA (OH)2
Asetyleeni on syttyvää, joten kosteuden läsnä ollessa CAC2 Se voi olla syttyvää. Kuitenkin, kun se on kuivaa, se ei ole kuitenkaan.
 CAC -kalsiumkarbidi2 Vesi -hc irti -asetyleenimuoto, syttyvä yhdiste. Kristina Kravets/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons.
CAC -kalsiumkarbidi2 Vesi -hc irti -asetyleenimuoto, syttyvä yhdiste. Kristina Kravets/CC BY-S (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons. Kalsiumkarbidi reagoi typen kanssa n2 CACN Calcio -syanamidin muodostamiseksi2-
Cac2 + N2 → CACN2 + C
Saada
Kalsiumkarbidia tuotetaan teollisesti sähkökaariuunissa, joka perustuu kalsiumkarbonaatin seokseen (Caco3) ja hiili (c), joka toimitetaan lämpötilassa 2000 ° C. Reaktio on yhteenveto seuraavasti:
Varas3 + 3 C → CAC2 + CO ↑ + Co2↑
Tai myös:
Cao + 3 c → cac2 + CO ↑
Sähkökaariuunissa on sähkökaari kahden grafiittielektrodin välillä, jotka kestävät muodostuneita korkeita lämpötiloja. Saadaan kalsiumkarbidi, jonka puhtaus on 80-85%.
Sovellukset
Asetyleenituotannossa
Teollisesti käytetään kalsiumkarbidireaktiota veden kanssa asetyleenin C tuottamiseksi2H2.
Cac2 + 2 h2O → HC≡CH + CA (OH)2
Tämä on kalsiumkarbidin tärkein käyttö. Joissakin maissa asetyleeni on erittäin arvostettu, koska se mahdollistaa polyvinyylikloridin tuottamisen, joka on eräänlainen muovi. Lisäksi asetyleeni palvelee hitsauksia korkeissa lämpötiloissa.
 HC≡CH -asetyleeniliekin metallit erittäin korkeissa lämpötiloissa. Kirjoittaja: Shutterbug75. Lähde: Pixabay.
HC≡CH -asetyleeniliekin metallit erittäin korkeissa lämpötiloissa. Kirjoittaja: Shutterbug75. Lähde: Pixabay. CO -päästöjen vähentämisessä2
CAC: sta alkaen saadut jäännökset saadut jäännökset2 (kutsutaan myös ”kalsiumkarbidilietteitä” tai “kalsiumkarbiditähteitä”) Ne palvelevat klinkkerin tai betonin saamisessa.
Voi palvella sinua: atomien elektronisen päästöjen teknologiset sovelluksetKalsiumkarbidimudassa on korkea kalsiumhydroksidipitoisuus (CA (OH)2) (noin 90%), jonkin verran kalsiumkarbonaattia (Caco3) ja pH on yli 12.
 Kalsiumkarbiditähteitä voidaan käyttää rakennusaktiivisuudessa betonin valmistukseen, mikä vähentää CO: n muodostumista2 mainitun teollisuuden. Kirjoittaja: Engin Akyurt. Lähde: Pixabay.
Kalsiumkarbiditähteitä voidaan käyttää rakennusaktiivisuudessa betonin valmistukseen, mikä vähentää CO: n muodostumista2 mainitun teollisuuden. Kirjoittaja: Engin Akyurt. Lähde: Pixabay. Näistä syistä voit reagoida SIO: n kanssa2 tai Al2JOMPIKUMPI3 muodostaa samanlainen tuotte.
Yksi ihmisen toiminnoista, joka tuottaa eniten yhteistyötä2 Se on rakennusteollisuus. Yhteistyökumppani2 Se syntyy kalsiumkarbonaatin itään reaktion aikana betonin muodostamiseksi.
Käyttämällä kalsiumkarbidi -mutaa kalsiumkarbonaatin korvaamiseksi (Caco3) On havaittu2 39%.
Kalsiumsyanamidin saamiseksi
Kalsiumkarbidia käytetään myös teollisesti kalsiumsyanamidin CACN: n saamiseksi2.
Cac2 + N2 → CACN2 + C
Kalsiumsyanamidia käytetään lannoitteena, koska maaperän vedessä siitä tulee syanamidi H2N = C = N, joka tarjoaa typpeä kasveille, välttämätön ravintoaine näille.
Metallurgisessa teollisuudessa
Kalsiumkarbidia käytetään seosten, kuten Ferroníquelin, poistamiseen. CAC on sekoitettu2 Sulan seoksella 1550 ° C: ssa. Rikki (t) reagoi kalsiumkarbidin ja kalsiumsulfidi CAS: n ja hiilen kanssa C:
Cac2 + S → 2 c + cas
Rikinpoistoa suositaan, jos sekoittaminen on tehokasta ja seoksen hiilipitoisuus on alhainen. Casclium -kalsiumsulfidi kelluu sulanseoksen pinnalla, missä se valitsee ja hylätä.
Useissa käyttötarkoituksissa
Kalsiumkarbidia on käytetty raudan rikin eliminoinnissa. Myös polttoaineena teräksen tuotannossa ja voimakkaana deoksidanttina.
Voi palvella sinua: aromaattinen elektrofiilinen korvaus: mekanismi ja esimerkitSitä käytetään hedelmien kypsymiseen. Kalsiumkarbidista vedellä syntyy asetyleeni, mikä indusoi hedelmien kypsymistä, kuten banaaneja.
 Banaanit voivat kypsyä käyttämällä CAC -kalsiumkarbidia2. Kirjoittaja: Alexas Photos. Lähde: Pixabay.
Banaanit voivat kypsyä käyttämällä CAC -kalsiumkarbidia2. Kirjoittaja: Alexas Photos. Lähde: Pixabay. Kalsiumkarbidia käytetään väärissä tykkeissä aiheuttamaan niitä karakterisoivan kovan räjähdyksen kohinan. Tässä käytetään myös asetyleenimuodostumaa, joka räjähtää kipinän kanssa esineen sisällä.
CAC2 Sitä käytetään signaalien tuottamiseen avomerellä merivoimien soihdussa, jotka itse ylläpitävät.
Lopetettu käyttö
CAC2 Sitä on käytetty SO -nimikkeissä. Näiden toiminta koostuu veden tippumisesta kalsiumkarbidiin asetyleenin muodostamiseksi, joka kytkeytyy päälle ja antaa siten valoa.
Näitä lamppuja käytettiin hiilikaivoksissa, mutta niiden käyttö lopetettiin metaanikaasun läsnäolon vuoksi4 Näissä kaivoksissa. Tämä kaasu on syttyvää ja karbidilampun liekki voi saada sen tuleen tai hyödyntämään.
 CAC -kalsiumkarbidilamppu2. Scehardt / pubi -verkkotunnus. Lähde: Wikimedia Commons.
CAC -kalsiumkarbidilamppu2. Scehardt / pubi -verkkotunnus. Lähde: Wikimedia Commons. Niitä käytettiin laajasti liuskekivi -kivikaivoksissa, kuparissa ja tinassa sekä ensimmäisissä autoissa, moottoripyörissä ja polkupyörissä, kuten etuvaloissa tai ajovaloissa.
Ne on tällä hetkellä korvattu sähkövalaisimilla tai jopa LED -valaisimilla. Niitä käytetään kuitenkin edelleen Bolivian kaltaisissa maissa, Potosí -hopeakaivoksissa.
Riskejä
CAC -kalsiumkarbidi2 Kuiva ei ole syttyvää, vaan kosteuden läsnä ollessa asetyleeniä, joka on.
Sammuttaa tulipalo CAC: n läsnä ollessa2 Vettä, vaahtoa, hiilidioksidia tai halogeenisammuttimia ei tule koskaan käyttää. Natrium- tai kalsiumhydroksidia tulisi käyttää.
Viitteet
- Ropp, r.C. (2013). Ryhmä 14 (C, SI, GE, SN ja PB) alkaliset maapallon yhdisteet. Kalsiumkarbidit. Alkalisten maapallon yhdisteiden tietosanakirjassa. ScienEdirect.com.
- Pohanish, r. P. (2017). C. Karbidikalsium. Sittigin myrkyllisistä ja vaarallisista kemikaalista ja karsioista (seitsemäs painos) käsikirjassa (seitsemäs painos). ScienEdirect.com.
- Aurinko, h. et al. (2015). Kemiallisesti yhdistettyjen kalsiumkarbidien uudelleenlähetysten ominaisuudet ja sen syventäminen sementtiominaisuuksissa. Materiaalit 2015, 8, 638-651. NCBI toipunut.Nlm.NIH.Hallitus.
- Nie, Z. (2016). Eco-materiaalit ja elinkaaren arviointi. Tapaustutkimus: CO2 Kalsiumkarbidilietteen klinkerin päästöanalyysi. Kehittyneen materiaalin vihreässä ja kestävässä valmistuksessa. ScienEdirect.com.
- Crundwell, f.K -k -. Et al. (2011). Sulan Ferronickelin jalostaminen. Rikkipoisto. Koltteen, koboltti- ja platinaryhmän metallurgiassa. ScienEdirect.com.
- Tressler, r.JA. (2001). Rakenteellinen ja termostruktuurikeramiikka. Karbidit. Materiaalitieteen ja tekniikan tietosanakirjassa. ScienEdirect.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.

